Справочник химика 21Оксигемоглобин такжеПОИСК
Известные формы
При соединении гемоглобина с глюкозой формируется гликозированный гемоглобин. Повышение его концентрации начинается при избыточном содержании глюкозы в крови, например, при сахарном диабете.
Всемирная Организация Здравоохранения официально признала анализы на уровень гликозированного гемоглобина самым эффективными методами диагностики сахарного диабета. Пациентам с такой патологией требуется диагностировать строение гемоглобина, биохимия для них проводится не реже одного раза в три месяца.
Специалисты выделяют ещё один тип гемоглобина — это фетальный гемоглобин, который отличается от нормального по своему строению и функциям. Данное вещество характерно для новорожденных, а содержание его в крови может доходить до 80%. К первому году жизни ребенка фетальный гемоглобин разрушается и почти целиком заменяется характерным для взрослых людей гемоглобином. Фетальный гемоглобин считается нормой для детей, но у взрослого человека его наличие говорит о развитии тяжелых заболеваний.
Оксигемоглобин
Оксивалериановая кислота 201 Оксигемоглобин 447 а – Оксикапроновая кислота 201 Оксикислоты 200 ел.
Характер кривой диссоциации оксигемоглобина зависит от температуры и рН крови.
Глубина падения процента оксигемоглобина была крайне незначительной, что свидетельствует о повышенной возбудимости дыхательного центра, которая, однако, несколько снижалась к концу работы.
Между пероксидазным действием оксигемоглобина и действием растительной пероксидазы не существует никакого качественного разлггеия п отношении природы окисляемого субстрата.
При этом от оксигемоглобина легко отщепляется кислород, который переходит в клетки. Окисляя продукты расщепления жиров и углеводов, кислород соединяется с водородом органических соединений и образует воду. Этот процесс дегидрирования осуществляется с помощью окислительных ферментов и сопровождается выделением большого количества энергии.
Свежая алая кровь ( оксигемоглобин) в только что взятом желудочном содержимом еще не указывает на наличие кровоточащей язвы, так как оболочка желудка могла быть повреждена зондом. Присутствие побуревшей крови ( солянокислый г е м и н) в только что полученном желудочном соке может служить весьма существенным указанием на изъязвление стенок желудка, если исключена возможность наличия проглоченной крови.
Дезоксигемоглобин ( но не оксигемоглобин) связывает 2 3-ди-фосфоглицериновую кислоту. Это соединение образуется в эритроцитах из 1 3-дифосфоглицериновой кислоты в боковой ветви схемы гликолиза. Анаэробные условия, следовательно, способствуют гликолизу и образованию 2 3-дифосфоглицерата. Повышенная концентрация последнего приводит к смещению равновесия и образованию дезоксигемоглобина с высвобождением кислорода.
Кроме того, система оксигемоглобин – гемоглобин участвует в еще одном своеобразном механизме поддержания постоянства рН крови.
Время сохранения исходного процента оксигемоглобина до работы было несколько укорочено, после работы удлинялось.
Способность вытеснять кислород из оксигемоглобина объясняется тем, что окись углерода в 200 – 300 раз обладает большим сродством с гемоглобином крови ( красными кровяными шариками), чем кислород.
Причина увеличения пероксидазного действия оксигемоглобина заключается, невидимому, в повышении степени дисперсности его раствора под влиянием кислоты. Выше определенной концентрации кислоты происходит разрушение высокомолекулярного, содержащего железо комплекса, сопровождающееся ослаблением пероксидазного действия.
Таким образом, превращение оксигемоглобина в гемоглобин сопровождается увеличением способности крови связывать двуокись углерода. Это явление носит название эффекта Холдейна. Гемоглобин служит источником катионов ( К), необходимых для связывания угольной кислоты в форме бикарбонатов.
Наиболее важным производным гемоглобина является оксигемоглобин ( НЬСЬ), который получается путем прямого присоединения молекулярного кислорода к гемоглобину. Кислород присоединяется к гемоглобину через железо при помощи добавочных связей. Оксигемоглобин очень нестоек и легко диссоциирует на гемоглобин и кислород уже при простом уменьшении парциального давления кислорода.
Наиболее важным производным гемоглобина является оксигемоглобин ( НЬО2), который получается путем прямого присоединения молекулярного кислорода к гемоглобину. Кислород присоединяется к гемоглобину через железо при помощи добавочных связей. Оксигемоглобин очень нестоек и легко диссоциирует на гемоглобин и кислород уже при простом уменьшении парциального давления кислорода.
На самом деле процесс образования оксигемоглобина не является чисто химическим, так как валентность железа после образования оксигемоглобина не меняется.
Понижение и повышение содержания гемоглобина, симптомы
Малокровие — это патологическое состояние, когда в крови снижается содержание эритроцитов — функционально полноценных кровяных клеток. Количественно это отклонение выражается степень уменьшения показателей гемоглобина в крови — это железосодержащий пигмент, придающий крови красную окраску.
Для пациента с недостатком гемоглобина характерен следующий внешний облик: бледность кожи на всем теле и побледнение видимых слизистых поверхностей.
При уменьшении концентрации по причине недостаточного поступления витамина В12 типичным является нарушение слизистой поверхности языка или по-другому глоссит — когда зык становится будто полированным, сильно болит и имеет ярко-красный оттенок. При некоторых разновидностях анемии с понижение концентрации гемоглобина из-за большого разрушения массы эритроцитов кожный покров начинает желтеть.
Также уровень гемоглобина в крови может подниматься, что также не хорошо для организма. Высокие показатели вещества формируются у людей, живущих в горах или у профессиональных альпинистов. Высокий гемоглобин для них норма, потому что он считается реакцией человеческого организма в качестве компенсации — так проходит приспособление к нехватке кислорода, содержащегося в воздухе при нормальных условиях.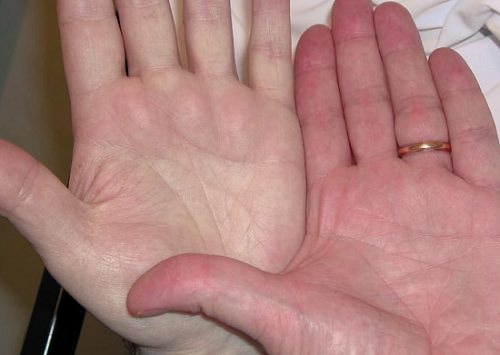
Высокий гемоглобин является недостатком концентрации в крови витамина В12 и фолиевой кислоты. Такое нарушение носит злокачественный характер.
Процесс восстановления нормы гемоглобина при его повышении проводится при помощи терапии витамином В12. Если вовремя и правильно проводить терапию, то прогнозы отклонений становятся благоприятными. При запоздалом лечении, на полгода и дольше, симптоматика нарушения работы нервной системы может приобрести хроническое течение и остаться на всю последующую жизнь.
Высокая концентрация гемоглобина вызывает развитие сердечнососудистых болезней, для лечения которых потребуется применение медикаментов, которые способствуют разжижению крови и препятствуют образованию тромбов.
Методика проведения анализа крови на гемоглобин
Для измерения количества гемоглобина в крови нет необходимости проводить забор крови из вены, ее берут из пальца. Это правильно, поскольку такой забор менее травматичен и предполагает изъятие минимального количества крови, чего вполне достаточно для определения исследуемого показателя. Анализ не предполагает особой подготовки: не требуется никаких диет или дополнительных манипуляций. Единственное ограничение — кровь следует сдавать натощак. Опять же, тот факт, что ее забор проводится из пальца, позволяет избежать голодных обмороков, иногда возникающих при взятии крови из вены натощак.
В настоящее время существует несколько групп методик, позволяющих сделать определение уровня гемоглобина в крови максимально точным. Еще недавно популярным был способ Сали, однако он недостаточно надежен и не отвечает современным требованиям. Поэтому вместо него предложены колориметрические и газометрические методы, а также способ измерения содержания железа в гемоглобиновой молекуле. Это правильно: время движется вперед, и современные технологии постепенно вытесняют более старые.
Помимо классического забора крови из пальца для измерения гемоглобина в лаборатории существует экспресс методика. Для этого существует специальный прибор — гемоглобинометр. Принцип действия прибора — колориметрический. Забор крови также осуществляется из пальца: для измерения ее требуется совсем немного: около 10 микролитров.
Такой прибор стоит достаточно дорого, поэтому если у вас бывает необходимость сдать кровь на гемоглобин пару раз в год, то покупать его не стоит: проще бесплатно сдать анализ в лаборатории. Однако у тех, кто вынужден постоянно контролировать концентрацию гемоглобина, данный прибор обязательно должен быть в наличии. В таком случае измерения можно проводить несколько раз в день, что просто необходимо при некоторых заболеваниях крови.
Конечно, данный прибор применяется не так часто, как, скажем, приборы для определения уровня сахара и холестерина, что связано, с одной стороны, с недостаточностью информированности населения, и с другой, не с такой высокой частотой распространения подобных патологий. Безусловно, использование таких приборов не исключает полностью необходимости сдавать анализ в лаборатории, где получаются более точные результаты.
Оксигемоглобин
Оксигемоглобин ( НЬСЬ) является непрочным соединением гемоглобина с кислородом. В этом виде в крови нормально содержится большая часть пигмента.
| Прибор для наблюдения диализа. |
Оксигемоглобин содержится в эритроцитах. Если их оболочки разрушить толуолом, то освободившийся оксиге-моглобин спонтанно образует кристаллы.
Оксигемоглобин является более сильной кислотой, чем гемоглобин.
Оксигемоглобин образует на единицу веса втрое меньше карбами-носоединений по сравнению с гемоглобином. Следовательно, когда гемоглобин, содержащий двуокись углерода в виде карбаминопро-теида, окисляется в легких, карбаминопротеид разлагается с выделением свободной двуокиси углерода. Образование карбаминопро-теида – это третий и последний механизм, с помощью которого двуокись углерода удаляется из орагнизма.
Оксигемоглобин представляет собой более сильную кислоту, чем гемоглобин. Он превращает Н2СО3 в НСОз в гораздо меньшей степени, чем гемоглобин. Поэтому в легких, когда образуется окси-гемоглобин, Н2СО3 скорее разлагается на двуокись углерода и воду, чем реагирует с оксигемоглобином. Затем двуокись углерода выделяется из организма.
Оксигемоглобин ( диамагнитен) под действием дитионита переходит в восстановленный оксигемоглобин ( парамагнитен) Ферригемоглобин титруют при определенной величине рН раствором KCN или KF для определения констант диссоциации ферригемоглобинцианида и ферриге-моглобинфторида ( рассчитывают по точкам пересечения кривых) Отсутствуют данные по органическим веществам.
Оксигемоглобин имеет в видимой части спектра две полосы поглощения при К 589 – 577 и К 556 – 536 нм, восстановленный гемоглобин при X 596 – 543 им, карбокснгемоглобнн А579 – 564 и Я 536 – 523 нм.
Оксигемоглобин обладает более сильной диссоциацией ионов водорода, чем гемоглобин. При взаимодействии с калиевой солью бикарбоната он вытесняет угольную кислоту и соединяется с калием.
Дважды перекристаллизованный оксигемоглобин ( из собачьей крови) и очищенная посредством осаждения алкоголем пероксидаза ( из хрена) растворялись в воде и полученные растворы соответственным разведением водой доводились до одинаковой силы пероксидазного действия.
Превращение оксигемоглобина в метгемоглобин, равно как дегенеративные изменения в эритроцитах и их распад, происходят под влиянием не самих рассматриваемых веществ, а продуктов их превращений – нитрозо – и гидроксиламинопроизводных ( Липшитц), По Гейбнер у, активный окислительный агент в этой реакции – свободный радикал ArNH – – O, образующийся в процессе восстановления нитрозогруппы в гидроксиламиногруппу.
Неустойчивость оксигемоглобина и оксимиоглобина при рентгеновском облучении и значительная устойчивость к диссоциации комплекса тема с окисью азота указывают, что это производное заслуживает внимания при кристаллографических исследованиях по крайней мере по двум важным причинам. Во-первых, Кон указывала, в что в случае гемоглобина и миоглобина электронный характер связывания окиси азота и кислорода может оказаться одинаковым. Во-вторых, d – конфигурация с неспаренным электроном, находящимся преимущественно на аксиальной орбитали dzz, позволяет экспериментально исследовать влияние частичного заполнения d2 – opбитaли на длины связей Fe-N. Таким образом, разностными методами Фурье можно исследовать влияние неспаренного электрона на длину связи катиона металла с аксиально направленным проксимальным остатком гистидина.
Модель оксигемоглобина, построенная по данным рентгенострук-турного анализа при разрешении 5 5 А.
Спектры кристаллического оксигемоглобина при – 2 показывают умеренный резонансный эффект и большое квадрупольное расщепление A.
Гемоглобин и оксигемоглобин неодинаково поглощают световые лучи длиной 620 – 680 мкм, что легло в основу метода оценки насыщения крови кислородом – оксигемометрии. По этому методу ушную раковину или кювету с кровью просвечивают электрической лампочкой и с помощью фотоэлемента определяют интенсивность световых волн указанной длины, проходящих через ткань уха или кювету с кровью.
Биология 8 класс
«Мир животных и растений» – Медведка обыкновенная. Насекомые. Грач. Растения. Мотылек. Cуслик. Перекати-поле. Молочай. Чибис. Сова. Медведка. Конопля. Птицы. Старички. Стрепет. Коршун. Животные. Рожь. Животные в повести А.П. Чехова «Степь». Перепел. Сверчки. Кузнечики. Соловьи. Коростель. Куропатка.
«Характеристика колорадского жука» – Колорадский жук. Типология проекта. Биологические особенности. Жизненный цикл колорадского жука. Теоретический этап. Откладка яиц. Личинка и куколка. Наблюдение. Опасный вредитель. Цикл развития колорадского жука. Взрослая особь. Приложение. Практическое значение. Развитие колорадского жука. Систематическое положение.
«Тест по анатомии» – Наука, изучающая строение организма. Объем головного мозга. Мышцы. Ткань, в котрой имеется хорошо развитое межклеточное вещество. Назовите органы пищеварительной системы. Белки, углеводы, вода. Назовите органы опорно-двигательной системы. Назовите органы эндокринного аппарата. Ткань, клетки которой плотно прилегают друг к другу. Главная часть клетки человеческого организма. Совокупность клеток и межклеточного вещества.
«Макро- и микроэлементы» – Значения натрия для организма человека. Значение макро- и микроэлементов в организме человека. Макроэлементы. Кислород. Кислород – самый распостаненный химический элемент на Земле. Что необходимо для “железного” здоровья. Вода. Макро- и микроэлементы. Вода для человеческого организма. Кислород входит в состав белков. Абсолютно необходимые вещества. Практическое исследование. Значения меди для организма человека.
«Вернадский Владимир Иванович» – Станция метро. Вернадский Владимир Иванович. Кроссворд. Бюст В.И.Вернадского. Ферсман Александр Евгеньевич. Свадьба Фигаро. Ответы к кроссворду. Психологический портрет. Юбилейные монеты. Поездки за границу. Научная деятельность Владимира Ивановича Вернадского. Научная деятельность. Федор Тютчев. Портрет В.И.Вернадского. Международный Геологический Конгрессс. Вернадский и искусство. Биография Вернадского.
«Вред фаст-фуда» – История. Основатели сети «Макдоналдс». История гамбургера. Реймонд Крок. Отрицательные стороны. Исследование. Последствия. Задачи. Диалог народов – диалог культур. Заключение. Символ сети. Выявление положительных и отрицательных сторон быстрого питания.
«Биология 8 класс»
Виды гемоглобина
Эмбриональный
С первых недель развития эмбриона в эмбриональном мешке образуются первые виды гемоглобина — Gover 1 и Gover 2. В норме к 12 недели развития плода эмбриональный гемоглобин полностью замещается фетальным.
Фетальный
Плодный гемоглобин (HbF) является следующим этапом в усовершенствовании гемоглобина. Он является основным видом на протяжении всей беременности и имеет более высокое сродство к кислороду, чем . К моменту родов его доля от общего количества гемоглобина составляет 50-80%. После рождения фетальный гемоглобин ребенка начинает усиленно распадаться и постепенно заменяется взрослым гемоглобином (HbA).
Взрослый
В первые месяцы жизни ребенка взрослый вид гемоглобина (HbA) полностью замещает плодный (HbF) и сохраняется на протяжении всей жизни человека. Имеют разные виды гемоглобина HbA:
- HbA1 — 98% от всего количества гемоглобина в крови
- HbA2 — 2%
- HbA3 — может встречаться в старых эритроцитах
- HbA1c — гликированный гемоглобин А
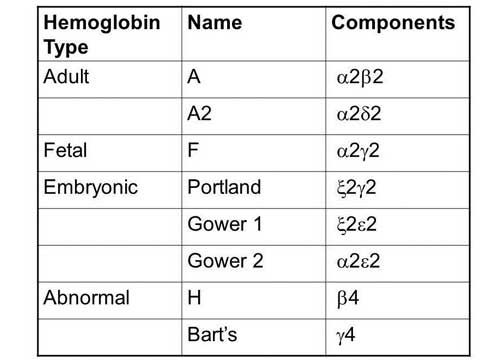 Виды гемоглобинов и цепи глобина в их составе
Виды гемоглобинов и цепи глобина в их составе
Патологические виды Hb
Мутации генов, ответственных за синтез альфа- и бета-цепей белка глобина, приводят к появления аномальных видов гемоглобина. В настоящее время известно более 100 аномальных гемоглобинов. В большинстве известных случаев способность гемоглобина переносить кислород и углекислый газ сохранена.
Сюда же можно отнести и гемоглобинопатии (например, серповидноклеточная анемия) и талассемии.
Формы гемоглобина
В процессе жизнедеятельности гемоглобин может связываться не только с кислородом и углекислым газом, но и некоторыми другими химическими элементами, которые непосредственным образом влияют на возможность гемоглобина выполнять свои функции.
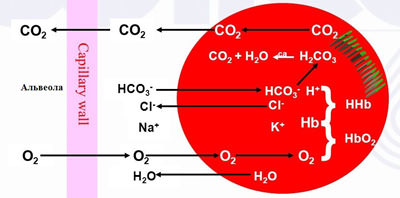 Газообмен в легких: окси-, дезокси- и карбгемоглобин
Газообмен в легких: окси-, дезокси- и карбгемоглобин
- Оксигемоглобин — так называется соединение гемоглобина с кислородом. Обозначается — HbO2. Именно такой формой гемоглобина насыщена артериальная кровь от легких и до капилляров тканей.
- Миоглобин — мышечная разновидность гемоглобина, которая содержится в скелетной мускулатуре и миокарде. Он является не переносчиком кислорода, а его депо на случай гипоксии. При снижении кислородной емкости крови, а также при гипоксии мышечной ткани при повышенной нагрузке, миоглобин начинает отдает тканям свой кислород. Миоглобин — это резерв кислорода для сердца и скелетных мышц при недостаточном его поступлении с обычным гемоглобином крови.
- Дезоксигемоглобин (HbH) — это «пустой» гемоглобин, который отдал кислород в тканях и не присоединил углекислый газ или, наоборот, отдал углекислый газ в легких, но не присоединил кислород. В подавляющем большинстве — это короткая промежуточная стадия в тканях или легких. В венозной или артериальной крови такой гемоглобин тоже встречается, но в небольшом количестве.
- Карбгемоглобин (HbCO2) — соединение гемоглобина с углекислым газом. Это соединение содержится в венозной крови, т.е. после капиллярной сети тканей и до легких.
- Метгемоглобин (HbOH) — образуется при окислении Fe2+ до Fe3+ под воздействием свободных радикалов, оксида азота, метиленового синего и др. Метгемоглобин утрачивает способность к переносу кислорода, поэтому повышение его в крови опасно для жизни.
- Цианметгемоглобин (HbCN) — патологическая форма гемоглобина, образующаяся в крови при присоединении цианидов (CN-) к метгемоглобину. Соединение цианидов с метгемоглобином применяется при лечении отравлений синильной кислотой.
- Карбоксигемоглобин (HbCO) — патологическая разновидность гемоглобина — очень стойкое соединение с угарным газом. Прочность связи углекислого газа с гемоглобином в 200 раз больше, чем у кислорода. В норме содержание HbCO в крови не должно превышать 1%.
Что такое фетальный гемоглобин
Фетальный гемоглобин также принято называть гемоглобин-F, оба названия соответствуют одному виду.
Гемоглобин-F- это такая форма гемоглобина, которая преобладает как в крови у плода до рождения, так и у новорождённых в период первых четырёх недель с момента появления на свет. Его можно назвать «детским» гемоглобином. В отличии от «взрослого» гемоглабина его преимущество в способности более быстро переносить кислород, но он хуже переносит температурные скачки и изменение кислотности. Ввиду того, что у младенцев объём крови намного меньше, он идеален для них.
Фетальный гемоглобин в крови начинает стремительно исчезать уже к двадцатому дню с момента появления на свет, а в последующий период вплоть до ста дней практически абсолютно исчезает из состава крови, составляя не больше одного процента от его общего количества у взрослых.

Комментарии
(0 Комментариев)