Осмотическое давление в природе и жизни человека
Биология — Осмотическое давление
Осмотическое давление избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.
Раствор, имеющий более высокое осмотическое давление по сравнению с другим раствором, называется гипертоническим, имеющий более низкое — гипотоническим.
Осмотическое давление может быть весьма значительным. В дереве, например, под действием осмотического давления растительный сок поднимается по ксилеме от корней до самой верхушки. Одни только капиллярные явления не способны создать достаточную подъёмную силу например, секвойям требуется доставлять раствор на высоту даже до 100 метров. При этом в дереве движение концентрированного раствора, каким является растительный сок, ничем не ограничено.
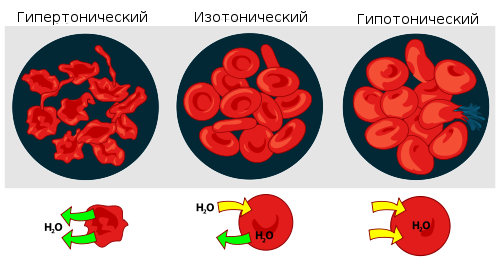
Взаимодействие эритроцитов с растворами в зависимости от их осмотического давления.
Если же подобный раствор находится в замкнутом пространстве, например, в клетке крови, то осмотическое давление может привести к разрыву клеточной мембраны. Именно по этой причине лекарства, предназначенные для введения в кровь, растворяют в изотоническом растворе, содержащем столько хлорида натрия, сколько нужно, чтобы уравновесить создаваемое клеточной жидкостью осмотическое давление. Если бы вводимые лекарственные препараты были изготовлены на воде или очень сильно разбавленном растворе, осмотическое давление, заставляя воду проникать в клетки крови, приводило бы к их разрыву. Если же ввести в кровь слишком концентрированный раствор хлорида натрия, то вода из клеток будет выходить наружу, и они сожмутся. В случае растительных клеток происходит отрыв протопласта от клеточной оболочки, что называется плазмолизом. Обратный же процесс, происходящий при помещении сжавшихся клеток в более разбавленный раствор, соответственно, деплазмолизом.
Величина осмотического давления, создаваемая раствором, зависит от количества, а не от химической природы растворенных в нём веществ, следовательно, осмотическое давление является коллигативным свойством раствора. Чем больше концентрация вещества в растворе, тем больше создаваемое им осмотическое давление. Это правило, носящее название закона осмотического давления, выражается простой формулой, очень похожей на некий закон идеального газа:
- ,
где i изотонический коэффициент раствора; C молярная концентрация раствора, выраженная через комбинацию основных единиц СИ, то есть, в моль/м, а не в привычных моль/л; R универсальная газовая постоянная; T термодинамическая температура раствора.
Это показыввает также схожесть свойств частиц растворённого вещества в вязкой среде растворителя с частицами идеального газа в воздухе. Правомерность этой точки зрения подтверждают опыты Ж. Б. Перрена: распределение частичек эмульсии смолы гуммигута в толще воды в общем подчинялось закону Больцмана.
Осмотическое давление, которое зависит от содержания в растворе белков, называется онкотическим. При длительном голодании, болезни почек концентрация белков в крови уменьшается, онкотическое давление в крови снижается и возникают онкотические отёки: вода переходит из сосудов в ткани, где πОНК больше. При гнойных процессах πОНК в очаге воспаления возрастает в 2-3 раза, так как увеличивается число частиц из-за разрушения белков. В организме осмотическое давление должно быть постоянным. Поэтому пациентам вводят изотонические растворы. Гипертонические растворы, у которых π больше, чем πПЛАЗМЫ, применяются в медицине для очистки ран от гноя, для удаления аллергических отёков, в качестве слабительных лекарств.
Закон осмотического давления можно использовать для расчёта молекулярной массы данного вещества.
|
Опыты на животных |
Отрицательная обратная связь >>> |
КРОВЬ
Кровь, лимфа, тканевая жидкость составляют внутреннюю среду организма. Они имеют относительно постоянный состав и физико-химические свойства, обеспечивает гомеостаз организма.
Система крови состоит из периферической крови, циркулирующей сосудами, органов кровотворен ния (красный костный мозг, лимфатические узлы, селезенка), органов кроворуйнування (печень, селезенка), нейрогуморальной системы регуляции.
Система крови выполняет следующие функции:
2) дыхательная (перенос кислорода и углекислого газа);
3) трофическая (обеспечивает органы организма питательными веществами)
4) экскреторная (выводит продукты обмена из организма);
5) терморегуляторная (поддерживает температуру тела на постоянном уровне)
6) защитная (иммунитет, свертывания крови)
7) гуморальная регуляция (транспортировка гормонов и биологически активных веществ);
8) поддержание постоянства pH, осмотического давления и тому подобное;
9) обеспечивает водно-солевой обмен между кровью и тканями;
10) осуществление креаторних связей (макромолекулы, переносятся плазмой и форменными элементами, осуществляют передачу информации между клетками).
Кровь состоит из плазмы и клеток (эритроцитов, лейкоцитов, тромбоцитов). Объемное соотношение форменных элементов и плазмы называют гематокритом. Форменные элементы составляют 40-45% объема крови, плазма%. Количество крови в организме взрослого человека составляет 4,5-6,0 литров (6-7% массы тела)
Плазма крови состоит из 90-92% Н20, органических и неорганических веществ. Белки плазмы: альбумин — 4,5%, глобулины — 2,3%, (альбумино-глобулиновый коэффициент в норме составляет 1,2-2,0), фибриноген — 0,2-0,4%. Белки составляют в плазме крови 7-8%, а остальные — другие органические соединения и минеральные соли. Глюкоза — 4,44-6,66 ммоль / л (по Хагедорна — Йенсен). Минеральные вещества плазмы (0,9%) — катионы Na + К +, Са 2+ и анионы Вот, НСO3_ и НРO42 +.
Значение белков плазмы крови:
1. Поддерживают онкотическое давление (С мм рт. Ст.).
2. Есть буферной системой крови.
3. Обеспечивают вязкость крови (для поддержания артериального давления).
4. Предотвращает свертыванию эритроцитов.
5. Участвуют в свертывании крови.
6. Участвуют в иммунологических реакциях (глобулины).
7. Переносят гормоны, липиды, углеводы, биологически активные вещества.
8. Есть резервом для построения тканевых белков.
Реакции обмена между электролитами. Ионные уравнения
Поскольку электролиты в растворах распадаются на ионы, то и реакции электролитов должны происходить между ионами. Взаимодействие ионов в растворе называется ионной реакцией. • Запишите формулировку в тетрадь. С участием ионов могут протекать как обменные, так и окислительно-восстановительные реакции. Рассмотрим обменные реакции электролитов в растворе, например взаимодействие между двумя солями: NaCl + AgNO3 =AgCl↓ + NaNO3 Хлорид натрия и нитрат серебра как сильные электролиты диссоциируют на ионы: NaCl ⇄ Na+ + Cl— AgNO3 ⇄ Ag+ + NO3— поэтому левую часть равенства можно записать в таком виде: Na+ + Cl— + Ag+ + NO3— = Рассмотрим полученные в результате реакции вещества: AgCl вещество нерастворимое, поэтому оно не будет диссоциировать на ионы, a NaNO3 — соль растворимая, прекрасно диссоциирует на ионы по схеме NaNO3 ⇄ Na+ + NO3—
NaNO3 — сильный электролит, поэтому правая часть равенства пишется так: … = Na+ + NO3— + AgCl Уравнение в целом будет иметь следующий вид: Na+ + Cl— + Ag+ + NO3— = Na+ + NO3— + AgCl Такое уравнение называется полным ионным уравнением. Сокращая в этом уравнении подобные члены, получаем сокращенное ионное уравнение Ag+ + Cl— = AgCl Итак, последовательность составления ионного уравнения. 1. Написать в ионном виде формулы исходных продуктов (тех, которые диссоциируют). 2. Написать в ионном виде формулы полученных продуктов (тех, которые диссоциируют). 3. Проверить, совпадает ли по абсолютной величине общее число положительных и отрицательных зарядов ионов в левой части равенства, а затем в правой. 4. Проверить, совпадает ли число одноименных ионов в левой и правой части равенства (учитывая атомы, входящие в состав недиссоциирующего вещества). На этом составление полного ионного уравнения заканчивается. • Запишите последовательность составления ионного уравнения в тетрадь. 5. Для составления сокращенного ионного уравнения следует найти в левой и правой частях уравнения подобные члены с одинаковыми знаками и исключить их из уравнения, а затем записать полученное сокращенное ионное уравнение. Приведенное сокращенное ионное уравнение выражает сущность не только этой реакции. Напишем несколько уравнений реакций, например: 1) НСl + AgNO3 = AgCl↓ + HNO3 Н+ + Cl— + Ag+ + NO3— = H+ + NO3— + AgCl↓
Ag+ + Cl— = AgCl
2Na+ + CO23— + 2H+ + 2NO3— = 2Na+ + 2NO3— + H2O + CO2↓
2К+ + 2Сl— + 2Na+ + SO24— ⇄ 2Na+ + 2Cl— + 2K+ + SO24— Сокращенного ионного уравнения здесь, разумеется написать нельзя
■ 83. Какие реакции называются ионными? (См. Ответ) 84. Как составляются полное ионное и сокращенное ионное уравнения? 85. Составьте молекулярные, полные ионные и сокращенные ион-ные уравнения следующих реакций: а) хлорид хрома (III) + нитрат серебра;
б) хлорид железа (III) + едкий натр; в) сульфид натрия + соляная кислота г) гидроокись кальция + азотная кислота; д) хлорид натрия 4- нитрат свинца; е) нитрат бария + сульфат натрия; ж) сульфат алюминия + едкое кали; з) хлорид бария + сульфат марганца; и) фосфат натрия + хлорид кальция. 86. Составьте ионные уравнения реакции укажите, какие из них будут обратимы и почему: а) едкий натр + хлорид калия; б) сульфат железа (III)4- хлорид бария; в) хлорид магния + нитрат натрия; г) нитрат железа (III) + едкое кали; д) хлорид цинка + едкий натр; е) сульфат натрия + хлорид меди (II) 87. Укажите, могут ли находиться в растворе одновременно ионы: а) Ва2+ и SO24—; б) Са2+ и Mg2+; в) Сu2+ и ОН—; г) Fe3+ и SO24—; д) S2- и Na+; е) PO34— и Mg2+. 88. Напишите несколько уравнений реакций нейтрализации и выведите для них общее сокращенное ионное уравнение. 89. С помощью каких веществ можно осуществить следующие реакции: а) Са2+ + СО23— → СаСО3 б) Fe2+ + 2OН— → Fe(OH)2 в) ЗСu2+ + 2PO34— → Cu3(PO4)2 (См. Ответ)
Большое значение имеют реакции ионного обмена, протекающие между электролитом и сложным, нерастворимым органическим веществом, в состав которого входит ион, способный обмениваться на другой, содержащийся в растворе электролита . Пропуская раствор электролита через такое вещество, называемое ионнообменником или ионитом, можно освободиться от нежелательных ионов, содержащихся в растворе. На этом основаны некоторые способы очистки воды, устранения ее жесткости. Для этой цели применяются как природные, так и приготовленные искусственным путем ионнообменники. Природные ионнообменники играют важную роль в почвенных процессах. Знание поведения электролитов в растворах, а также электронные представления о строении атомов и молекул позволяют по-новому рассматривать свойства оснований кислот и солей.
8
7 9
Степень диссоциации
Электролитическая диссоциация — процесс обратимый. Следовательно, одновременно с образованием ионов идет противоположный процесс — соединение ионов в молекулы. Между ними устанавливается равновесие. Чем разбавленнее раствор, тем полнее происходит диссоциация. О полноте диссоциации судят по величине степени диссоциации, обозначаемой буквой α. Степень диссоциации — это отношение числа диссоциированных молекул n к общему числу молекул N растворенного вещества, выраженное в процентах:
•Формулу и определение степени диссоциации запишите в тетрадь
Другими словами, степень диссоциации показывает, какой процент растворенных молекул распался на ионы. В зависимости от степени диссоциации различают электролиты сильные и слабые. Чем больше степень диссоциации, тем сильнее электролит. По величине распада на ионы различают электролиты сильные, средние, слабые. Сильные электролиты, например HNО3, НСl, H2SO4, едкие щелочи и все соли диссоциируют почти нацело (на 100%), Вместе с тем к сильным электролитам относят и те, у которых α > 30%, т. е. более 30% молекул распалось на ионы. Средние электролиты, например Н3РO4 и H2SO3, имеют степень диссоциации в пределах от 2 до 30%. Слабые электролиты, например NH4OH, H2CO3, H2S диссоциируют плохо: α Сравнение степени диссоциации разных электролитов, производят в растворах одинаковой концентрации (чаще всего 0,1 н.), так как степень диссоциации сильно зависит от концентрации раствора. На величину степени диссоциации влияет природа самого растворенного вещества, растворителя и ряд других внешних воздействий. Таким образом, когда говорят «сильная кислота» или «сильное основание», имеют в виду степень диссоциации вещества в растворе. В этом случае речь идет об этих веществах как электролитах. От степени диссоциации того или иного вещества зависит его поведение в химической реакции и ход самой реакции.
■ 80. Что характеризует степень диссоциации α? (См. Ответ)
81. Начертите в тетради таблицу:
| Классификация электролитов по степени диссоциации | ||
|
Сильные электролиты
(α >30%) |
Средние электролиты
(α от 2 до 30%) |
Слабые электролиты
(α |
На основании прочитанного текста приведите в каждой графе не менее двух примеров. 82. Что означают выражения «сильная кислота», «слабое основание»?
Осмотическое и онкотическое давление
Содержащиеся в плазме осмолиты (осмотически активные вещества), т.е. электролиты низкомолекулярных (неорганические соли, ионы) и высокомолекулярных веществ (коллоидные соединения, преимущественно белки) определяют важнейшие характеристики крови — осмотическоеионкотическоедавление. В медицинской практике эти характеристики важны не только по отношению к кровиperse(например, представление об изотоничности растворов), но и для реальной ситуацииinvivo(например, для понимания механизмов перехода воды через капиллярную стенку между кровью и межклеточной жидкостью , разделённых эквивалентом полупроницаемой мембраны — стенкой капилляра). В этом контексте для клинической практики существенны и такие параметры, какэффективноегидростатическоеицентральноевенозноедавление.
Осмотическоедавление() — избыточное гидростатическое давление на раствор, отделённый от растворителя (воды) полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану (в условияхinvivoею является сосудистая стенка). Осмотическое давление крови может быть определено по точке замерзания (т.е. криоскопически) и в норме составляет 7,5 атм (5800 мм рт.ст., 770 кПа, 290 мосмоль/кг воды).
Онкотическоедавление(коллоидно-осмотическое давление — КОД) — давление, которое возникает за счёт удержания воды в сосудистом русле белками плазмы крови. При нормальном содержании белка в плазме (70 г/л) КОД плазмы — 25 мм рт.ст. (3,3 кПа), тогда как КОД межклеточной жидкости значительно ниже (5 мм рт.ст., или 0,7 кПа).
Эффективноегидростатическоедавление— разница между гидростатическим давлением межклеточной жидкости (7 мм рт.ст.) и гидростатическим давлением крови в микрососудах. В норме эффективное гидростатическое давление составляет в артериальной части микрососудов 36–38 мм рт.ст., а в венозной — 14–16 мм рт.ст.
Центральноевенозноедавление— давление крови внутри венозной системы (в верхней и нижней полых венах), в норме составляющее от 4 до 10 см водного столба. Центральное венозное давление снижается при уменьшении ОЦК и повышается при сердечной недостаточности и застое в системе кровообращения.
Движение воды через стенку кровеносного капилляра описывает соотношение (Старлинг):
где: V — объём жидкости, проходящей через стенку капилляра за 1 мин; Kf — коэффициент фильтрации; P1 — гидростатическое давление в капилляре; P2 — гидростатическое давление в интерстициальной жидкости; P3 — онкотическое давление в плазме; P4 — онкотическое давление в интерстициальной жидкости.
Понятие о изо-, гипер- и гипоосмотических растворах введено в главе 3 (см. раздел «Транспорт воды и поддержание клеточного объёма»). Солевые инфузионные растворы для внутривенного введения должны иметь то же осмотическое давление, что и плазма, т.е. быть изоосмотическими (изотоническими, например, так называемый физиологический раствор — 0,85% раствор хлорида натрия).
Если осмотическое давление вводимой (инфузионной) жидкости выше (гиперосмотический, или гипертонический раствор), это приводит к выходу воды из клеток.
Если осмотическое давление вводимой (инфузионной) жидкости ниже (гипоосмотический, или гипотонический раствор), это приводит к поступлению воды в клетки, т.е. к их набуханию (клеточный отёк)
Осмотическийотёк(накопление жидкости в межклеточном пространстве) развивается при повышении осмотического давления тканевой жидкости (например при накоплении продуктов тканевого обмена, нарушении выведения солей)
Онкотическийотёк(коллоидно-осмотический отёк), т.е. увеличение содержания воды в интерстициальной жидкости, обусловлен снижением онкотического давления крови при гипопротеинемии (в основном, за счёт гипоальбуминемии, так как альбумины обеспечивают до 80% онкотического давления плазмы).
Для продолжения скачивания необходимо собрать картинку:
×
Как влияет питание
Правильное питание — залог здоровья всего человеческого тела. Изменение давления происходит в случае:
- Употребления большого количества соли. Это приводит к отложению натрия, из-за чего стенки сосудов становятся плотными, соответственно, уменьшается просвет. В таком состоянии организм не справляется с выведением жидкости, что приводит к увеличению циркуляции крови и повышению артериального давления, появлению отеков.
- Недостаточного употребления жидкости. Когда организму не хватает воды, нарушается водный баланс, кровь сгущается, так как уменьшается количество растворителя, то есть воды. Человек ощущает сильную жажду, утолив которую, запускает процесс возобновления работы механизма.
- Употребления вредной пищи или нарушения работы внутренних органов (печени и почек).
Влияние на человеческий организм
Бесспорно, осмос и осмотическое давление — это основные факторы, влияющие на упругость тканей и способность организма сохранять форму клеток и внутренних органов. Они обеспечивают ткани нутриентами.
Чтобы понять, что это такое, следует эритроцит поместить в дистиллированную воду. Со временем вся клетка наполнится водой, оболочка эритроцита разрушится. Этот процесс получил название «гемолиз».
Если клетку окунуть в концентрированный солевой раствор, она потеряет свою форму и упругость, произойдет ее сморщивание. Плазмолиз приводит к потере эритроцитом воды. В изотоническом же растворе сохранятся первоначальные свойства.
Осмотическое давление обеспечивает нормальное движение воды в организме.
- Заболевания
- Части тела
Предметный указатель на часто встречающиеся заболевания сердечно-сосудистой системы, поможет Вам с быстрым поиском нужного материала.
Выберете интересующую Вас часть тела, система покажет материалы, связанные с ней.
Prososud.ru Контакты:
Использование материалов сайта возможно только при наличии активной ссылки на первоисточник.
Все рекомендации, приведенные на сайте, носят ознакомительный характер и не являются предписанием к лечению.
Величина — осмотическое давление
Величина осмотического давления для разбавленных растворов неэлектролитов не зависит от природы растворителя и растворенного вещества.
Величина осмотического давления определяется по высоте Л подъема ртути в узкой трубке. Строго говоря, при этом способе измеряется осмотическое давление не изучаемого раствора, а несколько более разбавленного.
Величины осмотического давления, вычисленные Аррениусом по электропроводности для растворов различных электролитов, оказались очень близкими к величинам осмотического давления, определенным — другими экспериментальными методами.
Величина осмотического давления определяется по высоте h подъема ртути в узкой трубке. Строго говоря, при этом способе измеряется осмотическое давление не изучаемого раствора, а несколько более разбавленного.
|
Зависимости химического потенциала растворителя от давления. I — растворитель. II — раствор. |
Величина осмотического давления не зависит от природы мембраны.
Величина осмотического давления пропорциональна числу молекул всех веществ, растворенных в данном объеме раствора, и не зависит от природы растворенных веществ.
|
Системы с полупроницаемой мембраной. а — равновесие вода — раствор электролита MR, анионы которого не проходят через мембрану. б — распределение низкомолекулярного электролита, проникающего через мембрану. |
Величина осмотического давления также будет иной.
|
Зависимости химического потенциала растворителя от давления. I — растворитель, II — раствор. |
Величина осмотического давления не зависит от природы мембраны. В противном случае, используя два осмометра с мембранами из различных веществ, можно было бы создать вечный двигатель, соединяя отделения, в которых находится раствор, и поставив на пути растворителя из одного прибора в другой турбинку.
Величина осмотического давления пропорциональна числу молекул всех веществ, растворенных в данном объеме раствора, и не зависит от природы растворенных веществ. Это же относится и к величинам известных нам других свойств разбавленных растворов, таких как понижение давления пара растворителя, понижение температуры затвердевания раствора, повышение температуры кипения.
Величина осмотического давления также будет иной.
Величина осмотического давления, полученная для хорошо фракционированных образцов высокого молекулярного веса, не зависит от типа мембраны и может быть использована для определения молекулярного веса.
Величина осмотического давления пропорциональна числу частиц растворенного вещества в растворе, поэтому при наличии в растворе частиц различного размера ( в растворах полидисперсных веществ, например нефракционированного каучука) осмотические измерения дают среднюю величину молекулярного веса. Осмотические явления имеют место также в гелях, в ионообменных адсорбентах и в других системах в связи с ограниченной способностью коллоидных частиц к диффузии. В организмах осмотические явления играют важную роль в жизнедеятельности всех живых клеток, но в этом случае они осложняются сопряженными химическими реакциями в клетках, вследствие чего наблюдаемые распределения веществ; могут значительно отличаться от равновесных условий.
Осмотическое давление — плазма — кровь
Их соотношение регулирует осмотическое давление плазмы крови.
Гормоны задней доли гипофиза окситоцин и вазопрессин являются вместе с тем и простейшими белками. Окситоцин вызывает сокращение мускулатуры матки; вазопрессин поддерживает водное равновесие в организме, регулирует осмотическое давление плазмы крови, повышает кровяное давление. Оба они являются октапептидами циклического строения.
Как известно, поступление воды в организм через рот регулируется чувством жажды. Жажда возникаете результате рефлекторного возбуждения определенных участков коры головного мозга при первых признаках изменения осмотического давления плазмы крови. Вся введенная через рот вода более или менее быстро всасывается и поступает в кровяное русло.
Как известно, поступление воды в организм через рот регулируется чувством жажды. Жажда возникает в результате рефлекторного возбуждения определенных участков коры головного мозга при первых признаках изменения осмотического давления плазмы крови. Вся введенная через рот вода более или менее быстро всасывается и поступает в кровяное русло.
Основной биологический эффект окситоцина у млекопитающих связан со стимуляцией сокращения гладких мышц матки при родах и мышечных волокон вокруг альвеол молочных желез, что вызывает секрецию молока. Вазопрессин стимулирует сокращение гладких мышечных волокон сосудов, оказывая сильное вазопрессорное действие, однако основная роль его в организме сводится к регуляции водного обмена, откуда его второе название антидиуретического гормона. В небольших концентрациях ( 0 2 нг на 1 кг массы тела) Вазопрессин оказывает мощное антидиуретическое действие-стимулирует обратный ток воды через мембраны почечных канальцев. В норме он контролирует осмотическое давление плазмы крови и водный баланс организма человека. При патологии, в частности атрофии задней доли гипофиза, развивается несахарный диабет-заболевание, характеризующееся выделением чрезвычайно больших количеств жидкости с мочой. При этом нарушен обратный процесс всасывания воды в канальцах почек.
Наиболее эвригалинные формы бесхвостых амфибий могут повышать концентрацию мочевины в крови — тип адаптации, сходный с хрящевыми рыбами. Так, у зеленой жабы при повышении осмотического давления среды от 50 до 800 мосм / л содержание мочевины в крови увеличивается в шесть раз. Совершенно уникальна в этом отношении лягушка-крабоед Rana cancrivora, обитающая в мангровых зарослях Юго-Восточной Азии и постоянно контактирующая с морской водой. Как и у хрящевых рыб, осмотическое давление плазмы крови у этого вида несколько выше, чем в среде, что определяет осмотическое поступление воды в количестве, обеспечивающем необходимый уровень мочеобразования.
Из неорганических солей в моче человека в наибольшем количестве содержится хлористый натрий. За сутки с мочой здорового человека выводится обычно около 8 — 15 г NaCl. Концентрация NaCl в моче зависит от рода пищи. Напротив, при относительно высоком содержании поваренной соли в пищевом рационе человека выделение NaCl через почки соответственно увеличивается. Значение этого процесса для поддержания осмотического давления плазмы крови на постоянном уровне было рассмотрено в главе Водно-солевой обмен ( стр.
Явление осмоса играет важную роль в жизнедеятельности животных и растений. Оболочки клеток представляют собой перепонки, легко проницаемые для воды, но почти непрэницаемые для веществ, растворенных в клеточном соке. Поэтому пресноводные рыбы не могут жить в соленой воде ( где росм 28 атм), а морские рыбы — в пресной. Этим же объясняется и то, что когда мы ныряем в реке, открыть глаза больно, в то время как в море, где концентрация содей выше и приближается к концентрации солей в клетках роговицы, эта боль ощущается гораздо слабее. NaCl) на человека и теплокровных животных оказывает благотворное действие, так как его осмотическое давление ( — 7 атм) близко к осмотическому давлению плазмы крови.

Comments
(0 Comments)