Гемобластозы причины, симптомы и лечение
Лечебная тактика
После того, как диагноз будет установлен, врачи немедленно приступают к лечению опухолевого заболевания, чтобы предотвратить возникновение опасных для жизни последствий. Как правило, для всех терапевтических мероприятий применяется специализированная комната, которая отличается от других повышенной степенью защиты от негативного влияния внешних факторов (асептическая палата). В ее стенах, в зависимости от характера гемобластозов (костномозговые или внекостномозговые), их размеров и степени прогрессирования патологических изменений подбираются следующие возможные методики лечения:
пересадка костного мозга – эффективный способ терапии, благодаря которому можно навсегда избавиться от прогрессии лейкоза (болезнь с первичным расположением новообразований в костном мозгу). Трансплантационная костномозговая жидкость пересаживается от специально подобранного донора (как правило, ближайший родственник пострадавшего);
 Пересаживание костного мозга – один из эффективных способов лечения
Пересаживание костного мозга – один из эффективных способов лечения
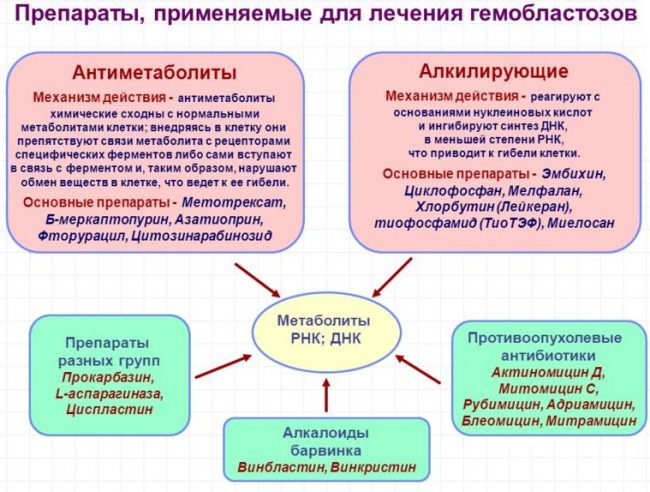
- использование специальных антител, которые качественно борются с образовавшимися, в кроветворной системе, гемобластозами;
- прием интерферона (защитный белок, имеющий противоопухолевое, противовирусное и иммунокорригирующее действо);
- производится процедура химиотерапии (использование фармакологических средств, которые пагубно влияют на негативные образования) – такая методика заключается в кратковременном применении большого количества противоопухолевого препарата, который быстро и качественно справляется с поставленной задачей удаления опухолевых клеток;
- применение лучевой терапии – способ, который часто проводится после химиотерапии и также хорошо борется с опухолевыми образованиями и уменьшением их в диаметре. Как правило, такой метод используют при бездействии химических препаратов, разрушении костномозговых тканей и при давлении гемобластозами на нервные окончания;
- оперативное вмешательство с последующим купированием лимфатических узлов и селезеночной капсулы – способ, который редко используется и назначается лишь в довольно тяжелых ситуациях.
Помимо вышеперечисленных способ терапии, которые направлены на удаление образовавшихся опухолевых клеток, существует также и симптоматическое лечение, способствующее устранению неприятных симптомов. Лекарственные средства, которые будут использоваться в таком случае, назначает исключительно квалифицированный специалист, основываясь на присутствующих признаках гемобластозов и стадии их запущенности. Возможен прием следующих медикаментов:
- антибактериальные препараты;
- гемостатические лекарства (останавливают возникшие кровоизлияния);
- препараты дезинтоксикационного действия (уменьшают негативное воздействие от опухолевого разложения);
- внедрение в организм пострадавшего донорских эритроцитов (если показатели, при изучении анализов крови, указывают на низкий уровень эритроцитов в кровеносной системе, что опасно для жизни больного).
Историческая справка
Вопросы диагностики и лечения лейкозов и других опухолевых заболеваний кроветворных и лимфоидных органов всегда были в центре внимания отечественных ученых — клиницистов-гематологов и гематопатологов. Родоначальником советской гематологии считается А.Н. Крюков, его ученики — И. А. Кассирский, в течение многих лет возглавляющий кафедру терапии №3 Центрального ордена Ленина института усовершенствования врачей, Г. А. Алексеев, М. Г. Абрамов, написавшие неоднократно переиздававшиеся основные руководства по клинической гематологии и цитологии.
Помимо этого, существовали и успешно развивались крупные школы гематологов — в Москве в ЦНИИГПК (Х. Х. Владос, М. С. Дульцин, Ф. Э. Файнштейн), в Ленинграде (Т. С. Истаманова, С. И. Шерман), в Риге (Л. И. Яворковский).
Теоретические основы диагностики онкогематологических заболеваний в новейшее время (60-70-е годы XX века) заложены трудами последователя А. А. Максимова, гематологов-экспериментаторов И. Л. Черткова, А. Я. Фриденштейна, на новом уровне продолживших изучение клеточных основ кроветворения и иммунитета и сыгравших значительную роль в развитии представлений о полипотентной стволовой гемопоэтической клетке и создании современной схемы кроветворения. Вышли заслужившие признание гематологов научные труды: «Новое в гематологии» (под ред. А. И. Воробьева и Ю. И. Лорие, 1974); «Нормальное кроветворение и его регуляция» (под ред. Н. А. Федорова, 1976); «Руководство по гематологии», т. 1-2 (под ред. А. И. Воробьева, 1-е изд., 1985, 2-е изд., 2000); «Клиническая онкогематология» (под ред. М. А. Волковой, 2000).
Становление гематологии в Украине связано с именами академиков Н. Д. Стражеско и Д. Н. Яновского, они создали уникальную школу клиницистов-гематологов и морфологов, выпустили первый «Атлас клинической гематологии» (1940). В 1940 г. Д. Н. Яновский опубликовал монографию «Острая лейкемия», остающуюся до сих пор, по нашему мнению, одной из лучших работ по указанной проблеме. Автор уже тогда прозорливо подчеркивал неоднородность морфологического субстрата заболевания и выделял лимфоидную, миелоидную и моноцитарную формы острого лейкоза с присущими им клинико-гематологическими особенностями. К сожалению, взгляды ученого на природу клеток при острых лейкозах не нашли должной поддержки, и на многие годы воцарились неоправданные представления об «остром гемоцитобластозе», «остром и хроническом ретикулезе» как синониме термина «острый лейкоз». В дальнейшем Д. Н. Яновский работал над «Руководством по клинической гематологии» (1-е изд., 1951; 2-е изд., 1962). Многолетние исследования представителей Киевской школы гематологов нашли отражение в опубликованных ими фундаментальных научных трудах, многие из которых стали настольными книгами для поколений гематологов. К их числу относятся: монография Н. Д. Стражеско, Д. Н. Яновского, М. А. Виноградской-Езерской «Пунктаты лимфатических узлов» (1953), книги М. А. Чепелевой «Патология лимфатических узлов (клинико-морфологическое исследование)» (1962), Н.Д. Стражеско, «Атлас клинической гематологии» (1963), Д. Н. Яновского, М. А. Чепелевой «Атлас цитологии экссудатов и транссудатов» (1968), Д. Н. Яновского, М. А. Чепелевой «Атлас цитологии пунктатов лимфатических узлов» (1969).
На достаточно высоком уровне клинико-морфологические исследования гемобластозов проводились и в других центрах Украины — Киевском, Львовском и Харьковском институтах гематологии и переливания крови, на кафедрах клинической лабораторной диагностики институтов усовершенствования врачей.
В 1960 г. в Институте экспериментальной и клинической онкологии МЗ Украины (ныне Институт экспериментальной патологии, онкологии и радиобиологии им. Р. Е. Кавецкого НАН Украины) создана первая в стране лаборатория по изучению этиологии и патогенеза лейкозов. Проводившиеся в ней под руководством академика НАН Украины З. А. Бутенко исследования были посвящены изучению механизмов лейкозогенеза, морфофункциональной характеристики стволовых кроветворных клеток и гемопоэтических клеток-предшественников, разработке принципов и теоретических основ диагностической цитохимии гемобластозов [].
К сожалению, за этим последовали годы застоя, и экономические трудности привели к снижению темпов научных исследований, в том числе и в онкогематологии, что не замедлило сказаться на уровне диагностики и качестве лечения больных гемобластозами.
Гемобластозы причины, виды и симптомы заболевания кроветворной ткани
Окончательная причина развития гемобластозов не до конца установлена, но известно несколько факторов риска появления заболеваний кроветворной ткани:
- облучение – ультрафиолетовое (солнечное, солярий), ионизирующее (всплеск заболеваемости после аварии на ЧАЭС), облучение при лечении новообразований внутренних органов, головного мозга;
- прием противоопухолевых препаратов – большинство из них крайне токсичны для организма, могут вызывать мутации клеток кроветворения;
- случаи лейкозов или лимфом у близких родственников;
- генетические врожденные аномалии – синдром Дауна, Блума, Луи-Барр и ряд других;
- вирусная инфекция — Эпштейна-Барр, ретровирус;
- наследственные или приобретенные нарушения обмена аминокислот.
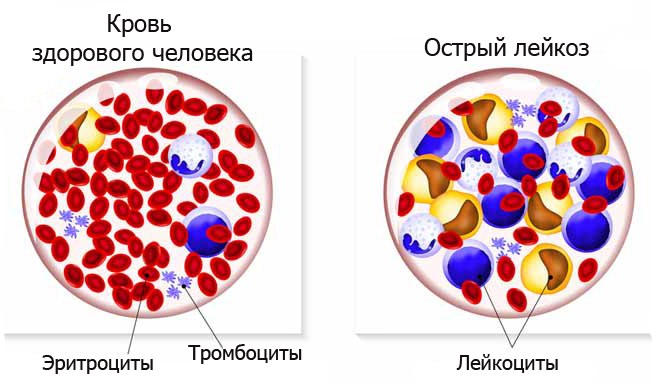
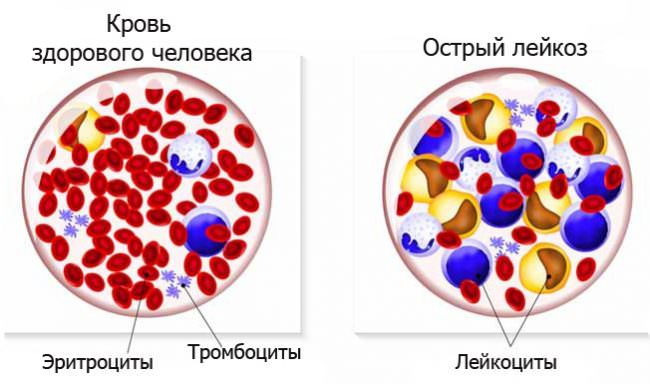
Классификация гемобластозов
Гемобластозы делят на опухоли, развивающиеся внутри костного мозга, названные миелопролиферативными, или лейкозами и вне его – лимфопролиферативные, или лимфомы, растущие в лимфоузлах. По мере прогрессирования раковые клетки из костного мозга переходят (метастазируют) в лимфоузлы и наоборот. В некоторых случаях болезнь с самого начала имеет признаки лейкоза и лимфомы.
Если источник опухоли – бласт, то есть незрелая стволовая клетка костного мозга, то лейкоз считается острым.
Он бывает:
- монобластным,
- миелобластным,
- смешанным миеломонобластным,
- эритроидным,
- мегакариобластным,
- промиелоцитарным.
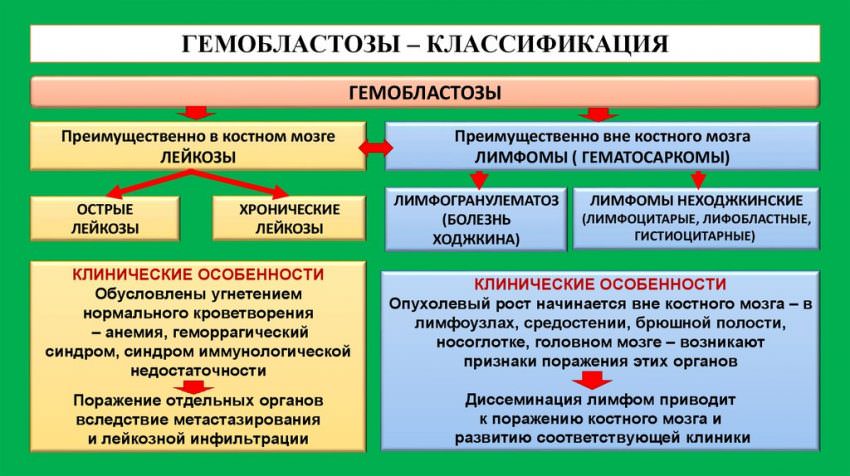
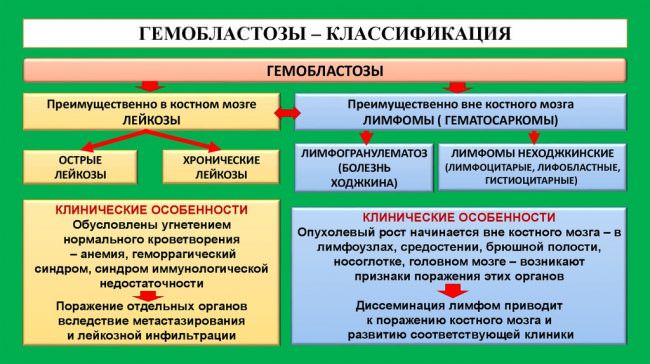
Когда бесконтрольное деление охватывает уже зрелые или промежуточные виды, то это характерно для хронической формы. К ним относится миелолейкоз, полицитемия, эритромиелоз, лимфолейкоз. Лимфомы бывают ходжскинскими и неходжкинскими. Определить вид болезни можно только после анализа костного мозга и крови, пункции лимфоузла, так как основная клиническая картина очень похожа.
Симптомы опухоли крови
Гемобластоз может начинаться по типу острой вирусной инфекции с высокой температурой и признаками интоксикации – тошнота, слабость, боль в костях. Но чаще всего признаки болезни малозаметные, особенно на ранней стадии:
- потливость;
- недомогание;
- длительное повышение температуры до 37,1-37,3 градусов;
- быстрая утомляемость;
- снижение аппетита;
- постепенная потеря веса.
К ним постепенно присоединяется увеличение лимфоузлов в заушной, шейной области, под мышками, в зоне паха, тяжесть и болезненность в верхней части живота из-за увеличения печени и селезенки. При разрастании лимфатической ткани внутри грудной клетки возникает отечность лица, переполнение вен шеи, затрудненное дыхание.
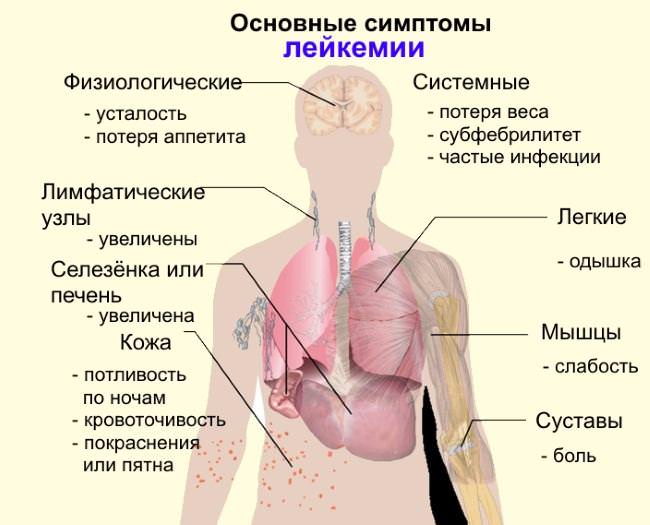
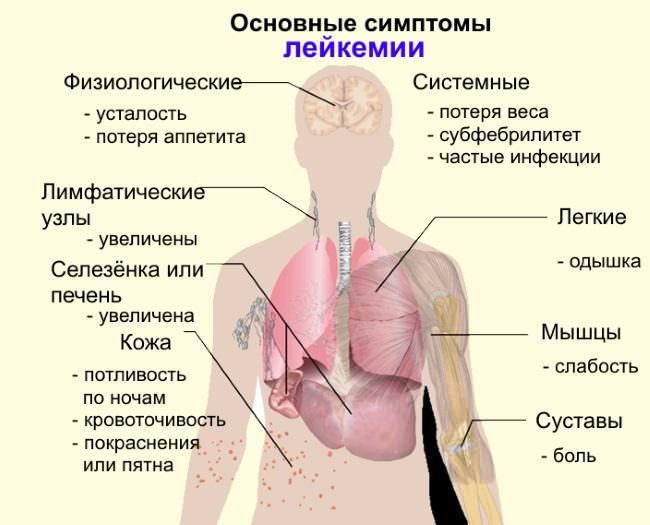
Из-за снижения сопротивляемости пациенты легко заражаются вирусными, бактериальными и грибковыми инфекциями. Они протекают с постоянными обострениями, имеют затяжное течение, трудно поддаются лечению. Особенно часто появляются пневмонии, которые при резком снижении иммунитета приобретают почти молниеносное прогрессирование со смертельным исходом.
Низкая свертывающая способность крови отражается в легком возникновении синяков, подслизистых кровоизлияний, кровотечений.
Лечение гемобластозов
Процесс терапии рака крови длительный. Пациента обязательно госпитализируют в отделение гематологии и назначают одну из схем химиотерапии в зависимости от вида и стадии гемобластоза. Вначале дозы препаратов высокие, а после улучшения показателей состава костного мозга и крови их уменьшают до поддерживающих, могут перевести для дальнейшего лечения в поликлинику по месту жительства.
При наличии показаний проводимся переливание тромбоцитарной или/и эритроцитарной массы, введение гормонов, антибиотиков, противогрибковых средств. Некоторым больным показано облучение лимфоидной ткани селезенки или ее удаление.
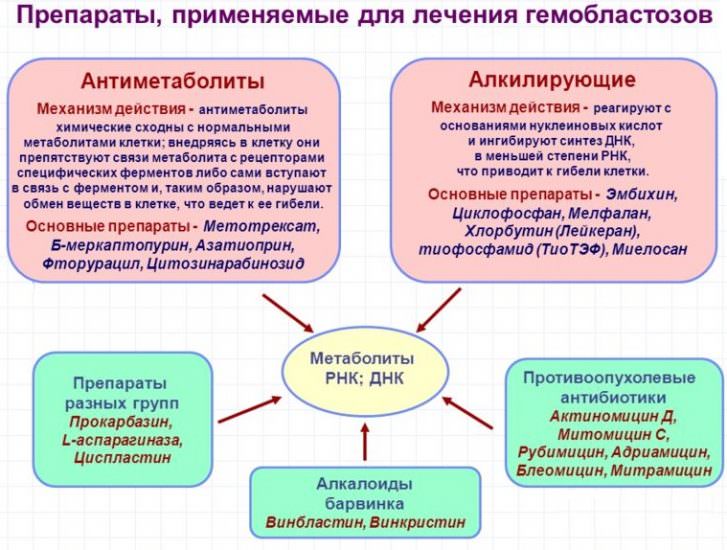
Терапия обычно переносимся достаточно тяжело, так как препараты имеют очень опасные побочные действия. Возрастает риск заражения крови (сепсис), разрушения печени, стенок кишечника, резкое падение иммунитета. Поэтому наиболее эффективным методом является пересадка костного мозга. Ее основная сложность – это поиск донора, подходящего по основным параметрам клеток (системе генов тканевой совместимости).
Важность рутинных методов в установлении диагноза онкогематологического заболевания
До сих пор сохраняется и, видимо, не изменится и в будущем сформулированное Н. Д. Стражеско и Д. Н. Яновским (1963) положение: «Точная диагностика клинических синдромов поражения кроветворной системы и правильная оценка функционального и морфологического состояния кроветворных органов до настоящего времени возможны только с помощью исследования крови и особенно пунктатов костного мозга». При системных процессах (острые и хронические лейкозы, множественная миелома, миелодиспластические синдромы) должны обязательно исследоваться хорошо приготовленные на обезжиренных предметных стеклах тонкие мазки периферической крови и мазки из пунктатов костного мозга после паноптической окраски по Романовскому-Гимзе или Паппенгейму. Нередко возникает необходимость в подобном исследовании полученных с помощью цитоцентрифуги мазков из спинномозговой жидкости и экссудатов из серозных полостей.
Детальное изучение клеточного состава костного мозга стало возможным после внедрения в клиническую практику предложенного М. И. Аринкиным в 1927 г. метода стернальной пункции.
При диагностике заболеваний с первично регионарным (локальным) опухолевым ростом (неходжкинские злокачественные лимфомы, лимфогранулематоз) решающее значение имеют результаты патогистологического исследования материала, полученного при эксцизионной биопсии, дополненные данными цитологического изучения отпечатков и пунктатов.
При некоторых формах гемобластозов (хронический идиопатический миелофиброз, алейкемические формы острых лейкозов, волосатоклеточный лейкоз, миеломная болезнь), метастазах опухолей в костный мозг и кости, для определения степени распространения процесса (стадии заболевания), при неходжкинских лимфомах и лимфогранулематозе приходится прибегать к трепанобиопсии с последующим изучением гистологических препаратов костного мозга. К сожалению, метод трепанобиопсии костного мозга в Украине применяется значительно реже, чем необходимо для верификации диагноза, и практически не проводится иммуногистохимическое исследование трепанобиоптатов.
ГЕМОБЛАСТОЗЫ — ЛЕЙКОЗЫ
В прошлом лейкозы нередко называли лейкемией или белокровием из-за появления в крови большого количества незрелых лейкоцитов. Но, так как данный признак не является характерным для всех без исключения видов лейкозов, от термина лейкемия отказались.
«Рак крови» не является правильным термином для обозначения онкологических заболеваний системы кровоснабжения и кроветворения, но является прочно устоявшимся в кругах, не связанных с медициной, поэтому статья так и озаглавлена. Чаще всего, когда говорят «рак крови», подразумевают какую-либо форму лейкоза или лимфосаркому, так как именно эти заболевания наиболее часто встречаются в гематологической практике.
Кроме лейкозов, к гемобластозам относятся также гематосаркомы — образования, возникшие из кроветворных клеток, но представляющие собой внекостномозговые разрастания опухоли. Значительно реже встречается такой вид гемобластоза, как лимфоцитома – опухоль, состоящая из зрелых лимфоцитов, либо разрастание, похожее на лимфоузел, при этом мало или совсем не поражается костный мозг.
Как при гематосаркомах, так и при лимфоцитомах опухолевые клетки способны со временем распространяться по организму и поражать костный мозг. На этой стадии обычно уже невозможно отличить гематосаркому от острого лейкоза, а лимфоцитому- от хронического лимфолейкоза.
Для всех гемабластозов характерна системность поражения, что делает возможным поражение остальных органов и тканей. Другой характерной особенностью течения данных заболеваний является то, что все внекостномозговые (нелейкемические) гемобластозы способны лейкемизироваться, т.е. метастазировать в костный мозг.
Метастазы гемобластозов в органы и ткани, не имеющие отношения к кроветворению, отражают новую стадию болезни: появление субклона (следующего поколения опухолевых клеток), адаптированного к данной ткани. Нередко метастазы в разных органах ведут себя независимо, часто имеют разную чувствительность к схемам химиотерапии.
Для разделения гемабластозов на зло- и доброкачественные в качестве критериев обычно принимают наличие или отсутствие опухолевой прогрессии. Т.е. доброкачественные опухоли характеризуются монотонным течением без появления качественных сдвигов, фактически не распространяются по организму. Злокачественные новообразования же, наоборот, прогрессируют довольно-таки быстро и отличаются клиническим динамизмом — быстрым нарастанием симптомов, которые заметны уже невооруженным глазом.
Лейкемические гемабластозы:
острые лейкозы, хронические лейкозы, парапротеинемические.
Нелейкемические гемабластозы:
лимфоцитомы,
лимфосаркомы,
нелейкемические гемобластозы нелимфатической природы.
Вопрос о причинах возникновения (этиологии) гемобластозов, как и других опухолей, сводится к определению наследственных или приобретенных условий (канцерогенов) и к выяснению возможного «фактора пуска»- события, запускающего процесс озлокачествления клеток.
На сегодняшний момент известен ряд установленных мутагенов, способных вызвать развитие новообразований:
- Ионизирующая радиация — канцерогенное действие излучения давно не подвергается сомнению. Примеры учащения заболеваемости лейкозами можно найти и в послевоенной Японии, и посмотрев на ветеранов Чернобыля или просто на людей, живших на расстоянии полутора километров от АЭС. Доказано влияние радиации при развитии хронического миелолейкоза вследствие лечения лимфогранулематоза облучением, острого миелобластного лейкоза- при профилактических облучениях головы во время лечения острого лимфобластного лейкоза.
- Химические мутагены — вредное влияние бензола известно еще с середины прошлого века — ряд исследований доказал безусловную зависимость повышения частоты заболеваемости лейкозами среди лиц, длительно подвергавшихся воздействию бензола. Исходя из этого, вполне логично было бы предположить, что и другие химические соединения так же могут обладать канцерогенными свойствами. Однако, такие наблюдения стали появляться лишь относительно недавно. В частности, выявилось, что некоторые цитостатические (азатиоприн, лейкеран, циклофосфан) и антибиотические препараты (левомицетин), используемые для лечения других онкологических заболеваний, могут вызывать миелоидные формы острых лейкозов.
- Роль мутагенов вирусной природы еще находится на стадии эксперимента, однако количество материала, накопленного в процессе исследований впечатляет: на сегодняшний день не вызывает сомнения факт, что некоторые вирусы способны неким образом перестроить клетку на генном уровне так, что она начинает непрерывно расти.
ЗАПИСЬ на КОНСУЛЬТАЦИЮ и ЛЕЧЕНИЕ — 8 (495) 66-44-315
Использование нетрадиционной медицины в терапии глиобластомы
Народные средства неспособны полностью избавить больного от опухоли, тем более что применять их нужно крайне осторожно. Полезным будет такой рецепт: настой болиголова
Для приготовления лекарства необходима столовая ложка сырья и 1/2 литра оливкового масла
Полезным будет такой рецепт: настой болиголова. Для приготовления лекарства необходима столовая ложка сырья и 1/2 литра оливкового масла.
После смешивания средство настаивается 2-3 недели. Далее, жидкость закапывается в нос по 2 капли.
Использовать можно и другие травы: аир, череду, цикорий.
Что касается питания, то оно должно способствовать нормализации метаболических процессов в организме человека.
Нельзя кушать горчицу, сыр, кислую капусту. Лучше отказаться от употребления сухофруктов, бобов, красного мяса.
Симптомы гемобластозов
Для классификации всех симптомов гемобластозов выделяют несколько синдромов. Гиперпластический (рост лимфатических узлов, печени и селезенки). Фиксируется боль и тяжесть в данной области. Происходит увеличение объема костного мозга, пациент жалуется на остеоалгию. Увеличивающиеся внутригрудные лимфатические узлы сдавливают верхнюю полую вену, в результате кровоток нарушен, что характеризуется появлением отеков шеи, рук, лица. Становятся заметны уплотнения на коже, деснах, в глотке.
При интоксикационном синдроме пациенты ощущают необъяснимую слабость, быстро утомляются, человек теряет вес, повышается потливость, температура тела.
Анемический синдром характерен слабостью, понижением работоспособности, головокружением. обмороками, звоном в ушах, кругами в глазах. Больные страдают одышкой, учащенным сердцебиением, чувствуют боль в сердце.
При геморрагическом синдроме становятся заметными подкожные кровоподтеки, кровотечения из носа. Синдром инфекционных осложнений означает присоединение различных инфекций в результате недостатка лейкоцитов в крови.
Гемобластозы могут начинаться остро, как ОРЗ, могут вначале преобладать кровотечения, начало заболевания бывает медленным, или скрытым. Гемобластозы у детей чаще скрываются под видом ОРЗ.
Можно выделить стадию обострения и ослабления (ремиссии) заболевания. Ремиссии выделяют полные и неполные. Полная ремиссия – это нормальное клиническое состояние не меньше месяца. При этом миелограмма отражает не больше 5 % онко-клеток.
Методика диагностирования
Начальный этап диагностических мероприятий, в первую очередь, заключается в опросе пациента и изучении его истории болезни (помогает установить причину возникновения образований). В момент опроса больной должен четко указать на существующие признаки болезни и вспомнить, давно ли они появились. Далее квалифицированным врачом проводится процедура пальпации и осмотра. При ощупывании определенных мест, на теле человека можно обнаружить значительное увеличение лимфоузлов и появившиеся уплотнения. Задачей осмотра является тщательное изучение кожных покровов и слизистых оболочек пострадавшего, чтобы обнаружить любые нестандартные изменения в них
Как правило, доктор обращает внимание на цвет мягких тканей, изучает состояние ротовой полости и горла (при таком заболевании в этих областях происходят воспалительные процессы, появляются гнойные выделения и часто присутствуют очаги кровоизлияний). После вышеописанных манипуляций опытный специалист направляет больного на прохождение следующих аппаратных и лабораторных диагностических мероприятий:
проводится общий анализ крови (пониженный уровень гемоглобина и эритроцитов указывают на положительный результат лабораторного анализа);
 Первым делом выполняется общий анализ крови
Первым делом выполняется общий анализ крови
- сдается общий анализ мочи (в нем можно обнаружить кровянистые элементы, которые указывают на присутствие кровоизлияний в области почек или мочеиспускательного канала);
- выполняется пункция для исследования состояния костного мозга (такая процедура позволяет установить характер и вид гемобластозов, а также определяют состояние кроветворной системы);
- производится пункция лимфоузлов;
- проводится цитохимическое и цитогенетическое исследование состояния костного мозга;
- делается рентгенографический снимок в области грудины, на котором определяется состояние сердечной мышцы, легких и лимфатических узлов;
- производится исследование с помощью компьютерной и магнитно-резонансной томографии (такое мероприятие помогает с точностью определить место локализации гемобластозов, определить их диаметр и форму);
- выполняется процедура люмбальной пункции (позволяет узнать о состоянии нервной системы).
Особенности
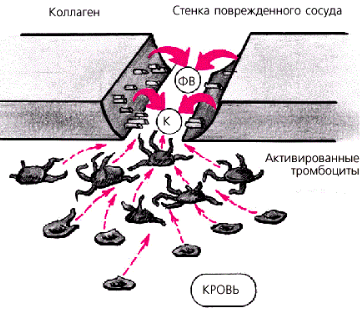 Процесс адгезии происходит на клеточном уровне, но как именно тромбоциты «понимают», что сейчас именно то время для уплотнения и образования тромба? Все дело в том, что каждая тромбоцитарная клетка содержит на поверхности специальные рецепторы. Когда организму угрожает опасность в виде потери крови, рецепторам приходит нервный импульс, говорящий о необходимости активизации в данный момент.
Процесс адгезии происходит на клеточном уровне, но как именно тромбоциты «понимают», что сейчас именно то время для уплотнения и образования тромба? Все дело в том, что каждая тромбоцитарная клетка содержит на поверхности специальные рецепторы. Когда организму угрожает опасность в виде потери крови, рецепторам приходит нервный импульс, говорящий о необходимости активизации в данный момент.
Антиэмболические рецепторы играют важную роль в продуктивности тромбоцитов. Если по каким-то причинам клетки не имеют подобных рецепторов (мутация) или они развиты лишь частично – это говорит о том, что вновь образованный тромб не сможет выполнить свои регенеративные функции на все 100%.
Слаборазвитые рецепторы не позволяют плотно прикрепляться к стенке сосудов, поэтому тромб в любую секунду может оторваться и свободно перемещаться по кровеносной системе. Если его диаметр меньше диаметра сосуда, то перемещение не усложняется. Однако если в процессе интенсивной выработки тромбоцитов кровяной сгусток наращивает свои объемы, то рано или поздно он способен закупорить сосуд, сделав его просвет минимальным. Это прекратит или заметно снизит кровоснабжение участка тела, что приведет к развитию заболеваний, связанных с недостаточным питанием клеток и недостатком кислорода.Подобная недостаточность рецепторов считается патологией, а также может передаваться по наследству, делая новорожденного уязвимым перед различными кровотечениями.
Процесс адгезии осуществляется только благодаря полному связыванию гликопротеина с коллагеном.
Недостаточная выработка хотя бы одного из этих компонентов ставит под угрозу целый процесс, значительно снижая свертываемость крови. Отсутствие должного уровня коллагеновых клеток и гликопротеина называется в медицине болезнью Бернара-Сулье, для которой характерны высокие риски развития кровотечения с невозможностью остановки крови без медицинского вмешательства.
Рассмотрим схему формирования адгезивного эффекта:
- При механическом воздействии образовался разрыв эпителиальной ткани, после чего образовалось незначительное кровотечение.
- В первые секунды по средствам нервных импульсов антиэмболические рецепторы получают сигнал о необходимости связывания тромбоцитов.
- Активно вырабатываются клетки коллагена, которые позволяют удержаться вновь образованному сгустку крови на внутренней стороне сосуда, не давая ему возможности уйти вместе с потоком крови.
- В свою очередь гликопротеин улучшает соприкосновение тромбоцита и коллагеновых клеток, делая их «союз» максимально прочным относительно других элементов крови.
Стоит заметить, что адгезия при нормальном уровне тромбоцитов и при отсутствии сигнала не запускается как биологический процесс. Для ее активации необходима предпосылка, которой является нервный импульс, полученный поверхностными рецепторами.
Сам процесс адгезии состоит из двух взаимозависимых и взаимодополняющих механизмов:
- Склеивание тромбоцитов и присоединение их к внутренней части стенки сосуда.
- Удержание кровяного сгустка на стенке сосуда и недопущение его отрыва потоком крови.
Процессы возникают одновременно и действуют параллельно. Однако, бывают ситуации, когда эти два механизма могут существовать и по отдельности, но эффективность адгезии в подобном случае минимальна. Чтобы удержать полученный путем склеивания тромбоцитов кровяной сгусток в нужном месте повреждения, необходимы такие микроэлементы, как:
- Фактор Виллебранда – ключевой гликопротеин, который позволяет тромбу крепиться к стенкам сосуда надежно. Имеет генетический код, а его недостаток может провоцировать различные патологии гемостаза.
- Витронектин – участвует в процессе обеспечения наиболее крепких связей поврежденного участка и тромба, путем удваивания проницаемости клеточных мембран.
- Ламинин – эти микрокомпоненты входят в состав базальных мембран, которые также участвуют в процессе адгезии.
- Фибронектин – способен связываться с другими гликопротеинами, поддерживая адгезивную связь.
Такое комплексное воздействие и быстрота реакции позволяет не беспокоиться о возможности больших кровопотерь.
Цитогенетические и молекулярно-генетические методы в диагностике гемобластозов
В последние годы особое внимание уделялось роли тех или иных генетических аномалий в развитии различных форм острых лейкозов, хронического миелолейкоза, неходжкинских злокачественных лимфом. При их выявлении используются как традиционные цитогенетические методы, так и высокочувствительная обратно-транскриптазная полимеразная реакция (RT-PCR)
Первые шаги в этом направлении делаются и у нас, в Институте молекулярной биологии генетики НАН Украины и НЦРМ АМН Украины. При ОМЛ к числу наиболее распространенных относятся реципрокные транслокации t(8; 21), inv(16), t(16; 16), t(15; 17) []. Выявляемые аномалии не всегда отличаются строгой линейностью и четко совпадают с ФАБ-вариантами, за исключением ОМЛ М3, при котором в 95% случаев определяется t(15; 17) (q22; q21)/PML/ RAR( .
При В-ОЛЛ наиболее часто встречающиеся аномалии: t(12; 21)/TEL-AML1 – у 10-30% детей при О-ОЛЛ, t (4; 11)/MLL-AF4 – в 50% случаев при врожденных лейкозах и t (9; 21)/BCR-ABL — у 25% взрослых. При Т-ОЛЛ в 29% случаев в ядрах бластных клеток обнаруживается продукт аберрантной транскрипции — белок TAL1 [].
На основе технологических достижений в области молекулярной генетики и полученных результатов предпринимаются попытки создания морфологической, иммунофенотипической, цитогенетической и молекулярно-генетической (MIC-M) классификации острых лейкозов [].
Определенные специфические транслокации хромосом и экспрессия продуктов ряда онкогенов и генов-супрессоров выявляются при некоторых формах неходжкинских злокачественных лимфом [].
Для дифференциальной диагностики хронического миелолейкоза (ХМЛ), ряда других хронических миелопролиферативных заболеваний и лейкемоидных реакций миелоидного типа уже давно эффективно используется определение так называемой филадельфийской (Ph’) хромосомы, образующейся в результате транслокации генетического материала между хромосомами 9 и 22 – t(9; 22)(q34,1; q11,21) или гибридного гена BCR/ABL [].
Применение цитогенетического и молекулярно-генетического анализа при учете данных морфоцитохимического исследования и иммунофенотипирования представляет третий уровень диагностики гемобластозов. Мы полагаем, что в недалеком будущем он также будет использоваться при решении сложных диагностических проблем и позволит выделять некоторые нозологические формы и варианты онкогематологических заболеваний, отличающиеся по механизмам возникновения, клинико-гематологическим и прогностическим признакам, оптимальным методам терапии.

Comments
(0 Comments)