Электрофизиологическое исследование сердца
Как проводится чреспищеводное электрофизиологическое исследование
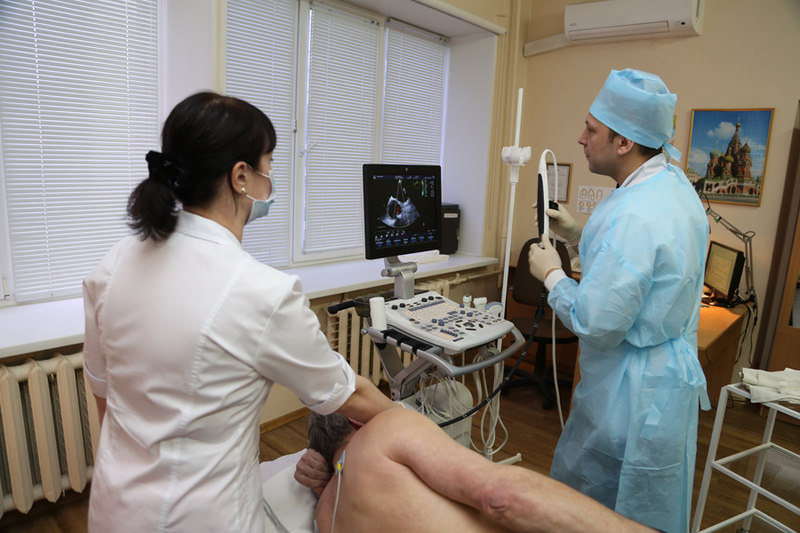
ЧПЭФИ может проводиться в поликлиническом или стационарном отделении функциональной диагностики. После замера артериального давления и частоты пульса снимают исходную электрокардиограмму. Затем обрабатывается анестезирующим раствором глотка для смягчения дискомфорта при введении зонда.
 Зонд для ЧПЭФИ
Зонд для ЧПЭФИ
Проводится через нос или рот стерильная трубка с наконечником, который снабжен электродом для подачи сигналов. На грудной клетке фиксируют датчики для стандартной ЭКГ. Глубина введения устройства – 35 — 40 см. Если все этапы были успешными, то начинается подача электроимпульсов. В это время могут быть частые сокращения сердца или чувство жжения в груди.
Сама процедура продолжается около получаса. В это время врач подает электрический ток на миокард и снимает показания его активности кардиографом. При проведении ЧПЭФИ бывает дискомфорт, но сильных болевых ощущений нет.

Важные вопросы пациентов
При столь серьезной патологии у пациентов возникает много вопросов. В них стоит разобраться подробнее.
Можно ли летать на самолете
Перелет для пациентов с пейсмекером не опасен, но при прохождении контроля перед посадкой (металлодетекторы, «ворота безопасности») нужно предварительно предупредить сотрудников аэропорта и, по возможности, исключить такую проверку. Это правило также актуально и при посещении супермаркетов, музеев.
Можно ли использовать мобильный телефон и компьютер
Телефон не должен находиться ближе 20 см от стимулятора, поэтому его запрещено носить в нагрудном кармане и подносить к стороне, где имплантирован прибор
Эти же меры предосторожности касаются любых беспроводных устройств (аудиоплеер, планшет)
Компьютер не представляет опасности, в том числе и ноутбук. Разрешено проведение компьютерной томографии.
О том, можно ли пользоваться микроволновкой и мобильным телефоном, если установлен кардиостимулятор, смотрите в этом видео:
Когда можно заниматься спортом
В первые 2 — 3 месяца нельзя допускать интенсивных нагрузок на руку со стороны стимулятора, ее не поднимают выше горизонтального положения и не отводят резким движением в сторону. Это необходимо для того, чтобы имплантация прошла успешно. Затем разрешается занятия плаванием и гимнастическими упражнениями, которые не предусматривают механическое действие на плечевой пояс. Запрещена вольная борьба, тяжелая атлетика, гребля.
Таким образом, современные электрокардиостимуляторы могут обеспечить больному со сложным нарушением ритма сердца достаточно комфортный образ жизни, если соблюдать меры предосторожности после установки
Проведение обследования и расшифровка результатов
Примерно за 30 минут до проведения чреспищеводной эхокардиографии больному с целью седации вводят успокоительные, противотревожные средства чаще бензодиазепинового ряда. Перед проведением манипуляции может потребоваться местное обезболивание. С этой целью глотку и основание языка обрабатывают спреем с местными анестетиками (лидокаин, дикаин). По показаниям процедуру можно проводить под общим наркозом
В этом случае особенно важно вести контроль за всеми показателями жизнедеятельности, потому что пациент не сможет подать знак об ухудшении самочувствия
УЗИ сердца через пищевод осуществляют в положении больного лежа на левом боку. Перед введением датчика в пищевод в ротовую полость устанавливают специальный загубник, защищающий слизистую оболочку рта и сам эндоскоп от повреждения. Затем эндоскоп проводят в глотку, больной, делая глотательные движения, проталкивает его в просвет пищевода. Врач останавливает датчик в проекции сердца и осматривает его структуры, отмечая полученные результаты. Пациент в это время должен спокойно неподвижно лежать, дышать носом, при необходимости следовать распоряжениям медицинского персонала.
Сама процедура занимает обычно не больше 20 минут, больше времени требуется на предварительную подготовку и последующий анализ результатов. После завершения процедуры не желательно есть и пить около двух часов, пока работает анестетик.
В протоколе исследования врач-диагност описывает следующие отделы и структуры сердца, доступные для осмотра методом чреспищеводной эхокардиографии:
- предсердное ушко слева;
- правое предсердие:
- венечные артерии и венечный синус;
- легочные вены:
- межпредсердная перегородка;
- аортальная дуга;
- нисходящая часть грудного отдела аорты.
При описании характеризуют их размеры, форму, четкость и правильность контуров, наличие тромбов, аневризм, объемных образований, патологий клапанов и сердечных сосудов.
Возможные осложнения
- прободение пищевода эндоскопом;
- кровотечение из сосудов пищевода при их механической травме;
- инфицирование пищевода, развитие эзофагита;
- возникновение аритмий;
- нарушение дыхания;
- повреждение слизистой оболочки ротовой полости, глотки, пищевода.
Если чреспищеводная эхокардиография выполнялась опытным доктором с соблюдением всех технических и гигиенических норм, то возникновение осложнений маловероятно. При ухудшении состояния пациента во время манипуляции и развитии острых осложнений процедуру немедленно прекращают и оказывают необходимую медицинскую помощь.
В норме последствиями проведения чреспищеводного исследования сердца может быть дискомфорт, боли и першение в горле, болезненность при проглатывании пищи, которые проходят через несколько дней. Кроме того — некоторая сонливость и заторможенность непосредственно после эхокардиографии, связанная с введением седативных препаратов.
Чреспищеводная ЭхоКГ – высокоинформативная процедура, позволяющая диагностировать многие жизнеугрожающие заболевания. Она требует специальной подготовки, вызывает определенный дискомфорт при проведении, однако, те результаты, которые получают с ее помощью, зачастую спасают человеку жизнь и сохраняют здоровье.
Возможные осложнения
Большинство пациентов хорошо переносят обследование, так как эта методика является безопасной. Но все же нужно учитывать возможность следующих осложнений:
- гиперчувствительность к анестезирующему раствору (отек, спазм гортани, анафилактическая реакция, вплоть до шока), поэтому при склонности к аллергии предварительно проводят пробы;
- инфаркт миокарда;
- приступ нарушения ритма;
- тромбоэмболия легочной артерии;
- боль в сердце по типу стенокардии.
Для предотвращения таких ситуаций необходимо пройти полное кардиологическое обследование перед ЧПЭФИ.
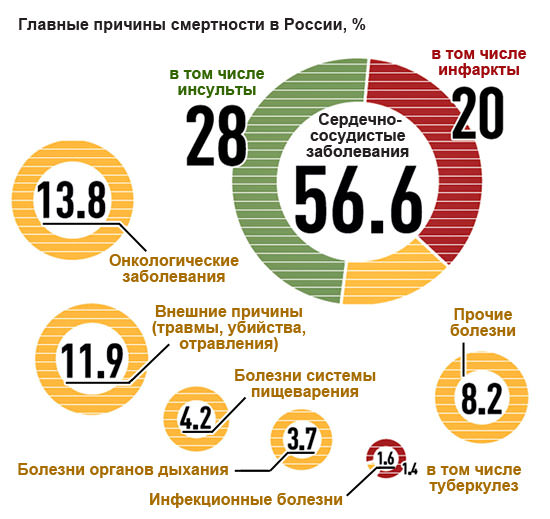 Причины, по которым не стоит откладывать обследование сердца
Причины, по которым не стоит откладывать обследование сердца
Основные функции электрокардиостимулятора сердца
Прибор для ЭКС состоит из металлического корпуса, в котором есть батарея и микропроцессор. Он образует импульсы для сердечной мышцы только при условии, что нет собственной электрической активности сердца, а если восстанавливается нормальный естественный ритм самого миокарда, то ЭКС останавливается.
Устройства могут быть снабжены датчиками, которые перенастраивают ритм в зависимости от активности дыхания, нагрузки на сердце во время движения или волнения, уровня стрессовых гормонов в крови. Встраиваются в некоторые стимуляторы режимы для предотвращения приступов фибрилляции или тахикардии.
Врач при помощи специального аппарата имеет возможность получить данные о деятельности сердца, считывая накопленную информацию в памяти кардиостимулятора за определенный период времени. Это поможет подобрать оптимальный ритм работы прибора и медикаментозную терапию. Контроль за работой стимулятора проводится не реже раза в полугодие.
Чреспищеводная электрическая стимуляция сердца
Метод ЧПЭС достаточно широко используется при обследовании больных ИБС. Основными
аспектами его применения следует считать изучение состояния коронарного резерва,
а также использование в качестве неинвазивного аналога электрофизиологического
исследования сердца для уточнения характера функционирования синусового узла,
атриовентрикулярного соединения и топики пароксизмальных нарушений сердечного
ритма.
В отличие от таких проб как велоэргометрия и холтеровское мониторирование
ЭКГ, ЧПЭС позволяет создать селективную нагрузку на миокард, поскольку при кардиостимуляции
существенно не увеличиваются ни сердечный выброс, ни венозный возврат крови.
Немаловажным обстоятельством в пользу этого метода является и то, что он не
требует активного участия самого больного. В определенной степени ЧПЭС безопаснее,
чем проба с физической нагрузкой, а признаки ишемии миокарда быстро исчезают
после прекращения исследования.
Метод ЧПЭС можно использовать у многих больных, которым противопоказано
проведение пробы с физической нагрузкой, например, при заболеваниях опорно-двигательного
аппарата и легких, поражении сосудов (артерий и вен) нижних конечностей, при
высокой АГ, при детренированности больного. Нецелесообразно проводить ЧПЭС больным
с постоянной формой мерцательной аритмии и при атриовентрикулярной блокаде (невозможность
навязать сердцу искусственный ритм). Кроме того, изучение коронарного резерва
затруднено при блокадах ножек пучка Гиса, а также в случаях деформации желудочкового
комплекса у пациентов с синдромом WPW. Абсолютным противопоказанием к
применению ЧПЭС являются заболевания пищевода.
Исследование проводится в специально оборудованном помещении, оснащенном кардиостимуляционной,
регистрирующей и реанимационной техникой. Пациенту в горизонтальном положении
без анестезии через носовые ходы в пищевод вводится провод-электрод на глубину
25–45 см. Контроль за его положением осуществляется по электрограмме из
пищевода, ориентируясь на максимальную амплитуду зубца Р на ЭКГ. Для изучения
аритмических событий преимущественно используется многополюсный электрод, позволяющий
одновременно осуществлять стимуляцию и регистрировать ЭКГ на уровне левого предсердия.
Применение современной техники в ряде случаев дает возможность изучать потенциалы
пучка Гиса. Для ЧПЭС используются кардиостимуляторы, генерирующие импульсы продолжительностью
до 20 мм с плавной регулировкой напряжения до 50 В (или силой тока до 5 мА).
В зависимости от целей исследования, ЧПЭС осуществляется в постоянно возрастающем
ритме (стресс-тест для изучения коронарного резерва), либо прерывисто. В любом
случае ЧПЭС начинается с частоты стимуляции, превышающей на 10 имп/мин спонтанный
синусовый ритм с последовательным его увеличением каждую минуту на 10 имп до
достижения частоты 160 имп/мин, на которой стимуляция продолжается в течение
2 мин. В случае возникновения во время ЧПЭС при частоте искусственного ритма
менее 160 имп/мин тахизависимой атриовентрикулярной блокады, внутривенно вводится
атропин (1–2 мл 0,1 % раствора) и исследование продолжается в соответствии
с имеющимся планом.
Пробу прекращают при достижении ЧСС 160 в мин, при появлении электрокардиографических
или клинических (приступ стенокардии) признаков ишемии миокарда. Однако возникновение
приступа стенокардии во время проведения исследования довольно трудно отличить
от неспецифических ощущений в грудной клетке, связанных с определенным дискомфортом
самой ЧПЭС
Поэтому основное внимание сосредоточено на изменениях ЭКГ
Признаки ишемии на ЭКГ такие же, как и при пробе с физической
нагрузкой, только непосредственно во время стимуляции во внимание принимается
депрессия сегмента ST не менее чем на 2 мм. Однако сама кардиостимуляция может
искажать положение сегмента ST, поэтому более специфичным для ишемии
миокарда является сохранение его депрессии в первых 3–5 кардиоциклах после
прекращения ЧПЭС
При этом в постстимуляционных циклах снижение сегмента ST
на 1 мм рассматривается как достоверный признак ишемии. Отсутствие изменений
сегмента ST при достижении частоты 160 имп/мин позволяет считать пробу отрицательной.
Диагностическая ценность ЧПЭС примерно такая же как и у пробы с физической
нагрузкой. При этом возникновение признаков ишемии при частоте стимуляции менее
100 имп/мин указывает на наличие выраженного снижения коронарного резерва. Для
увеличения чувствительности и специфичности ЧПЭС часто комбинируются с ультразвуковыми
методами исследования (стресс-эхокардиография), либо с фармакологическими пробами.
| Полное оглавлениераздела для врачей |
Систолическая функция
Основным и наиболее часто используемым показателем суммарной сократимости ЛЖ является ФВ. Наиболее широкое распространение получил метод определения ФВ по одномерной эхоКГ, который состоит в измерении КДР и КСР с последующим вычислением объемов ЛЖ:
КДО–КСО
ФВ = ———————• 100%.
КДО
Однако этот метод имеет серьезные недостатки из-за того, что, во-первых, у очень многих больных не удается достичь прохождения линии сканирования строго перпендикулярно к межжелудочковой перегородке, что необходимо для точности расчетов, во-вторых, формула Тейхольца для расчета объема ЛЖ верна только тогда, когда его геометрия правильная.

Таблица 7.2
+ Наименьшая ценность (применимость); ++++ наибольшая ценность; «–» не применимо; # если сигнал допплеровского тока крови субоптимальный, введение эхоконтрастного агента может улучшить качество сигнала; *с контрастом (внутривенное введение солевой смеси); 2D — двухмерный режим.
У пациентов с ИБС и при некоторых других заболеваниях преимущественно в систолу геометрия ЛЖ нарушается. Также нельзя забывать и о том, что при этом методе учитывается сократимость только базальных отделов ЛЖ. Из-за этих же причин фракция укорочения и скорость циркулярного укорочения не могут использоваться как показатели систолической функции ЛЖ (они также определяются по базальным сегментам ЛЖ).
Поэтому были предложены другие, планиметрические методы определения объемов ЛЖ в систолу и диастолу с последующим расчетом ФВ. При этих методах используется верхушечный доступ или комбинация верхушечного доступа с парастернальным доступом по короткой оси (методы Bullet, Simpson и др.). Проведение исследования этими методами требует очень много времени при их довольно низкой точно-сти. Из-за этого они не нашли широкого применения при рутинном обследовании больных.
Часто опытные врачи оценивают ФВ визуально. Результаты исследований свидетельствуют, что при определенной квалификации визуальная оценка ФВ является очень точной.
В настоящее время одной из самых точных и в то же время простых методик определения ФВ является вычисление соотношения ударного объема ЛЖ, полученного при импульсной допплерографии в выносящем тракте ЛЖ на уровне аортальных створок, к КДО, рассчитанному по формуле Тейхольца. Данный метод позволяет оценивать систолическую функцию ЛЖ у больных с сегментарными нарушениями сократимости, а также при выраженной митральной недостаточности, когда значительная часть крови в систолу выбрасывается не в аорту, а возвращается в левое предсердие. Этот метод точно регистрирует минимальные изменения ФВ в динамике, что особенно ценно при оценке течения заболевания и эффективности лечения пациентов с систолической дисфункцией ЛЖ. В норме суммарная сократимость ЛЖ должна составлять >55%. Удобно делить нарушения суммарной сократимости ЛЖ на следующие степени: умеренное снижение (ФВ ЛЖ — 40–55%), снижение средней тяжести (ФВ ЛЖ — 30–40%), выраженное снижение (ФВ ЛЖ
Данная классификация является довольно удобной и позволяет следить за течением болезни и эффективностью терапии, а также точно оценивать прогноз пациентов.
У больных с СН большое прогностическое значение имеют размер полости ЛЖ в базальном отделе и ФУ. Если базальные отделы ЛЖ сокращаются удовлетворительно, то функционирует «левожелудочковая манжетка», обеспечивающая достаточный выброс крови в аорту. У больных с удовлетворительной сократимостью базальных отделов отмечают значительно лучший прогноз, чем у тех, у которых один или несколько базальных сегментов сокращаются патологически. Информативность исследования повышается, если наряду с величиной ФВ одновременно оценивать индекс сократимости ЛЖ, который характеризует выраженность сегментарных нарушений.
Для характеристики суммарной сократимости ЛЖ имеет значение и оценка движения митральных створок. При значительно сниженной суммарной сократимости ЛЖ в раннюю диастолу происходит патологическое прикрытие митральных створок вследствие высокого конечно-диастолического давления в ЛЖ.
Для определения систолической функции ЛЖ можно использовать допплер-эхоКГ. Для этого рекомендуется определять время ускорения потока и временной интеграл скорости потока в выносящем тракте ЛЖ. Если сократимость ЛЖ снижена, то уменьшается площадь временного интеграла скорости и время ускорения, которое определяется от начала ускорения потока до достижения максимальной скорости.
Суть метода
Когда пациенты слышат от врача назначение: сделать чреспищеводную эхокардиографию, – большинство из них даже не знает, что это такое. Суть исследования заключается во введении ультразвукового датчика с помощью эндоскопа в полость пищевода, на несколько сантиметров не доходя до желудка.
Это целесообразно в связи с прилеганием сердца к пищеводной стенке. При этом для хорошей его визуализации ультразвуку нужно пройти расстояние менее сантиметра. Для сравнения: при УЗИ-исследовании сердца через переднюю грудную стенку ультразвуковая волна должна миновать кожные покровы с подкожной жировой клетчаткой, мышечный слой, легкие. Конечно, пищеводное ЭхоКГ дает более широкие диагностические возможности. В частности, позволяет рассмотреть следующие сердечные структуры:
- ушко левого предсердия;
- заднюю стенку сердца;
- аортальную дугу;
- коронарные артерии, из которых кровоснабжается сердечная мышца.
Правила поведения пациентов с кардиостимулятором сердца

- нельзя находиться близко к микроволновой печи;
- для диагностики не используется магнитно-резонансная томография;
- электрические методики физиотерапии и косметологии запрещены;
- УЗИ грудной клетки не назначается;
- не допускается смещение или удары в области имплантата;
- линии электропередач пересекаются вблизи опоры;
- электрокоагуляция при операциях не проводится.
Рекомендуем прочитать о синоаурикулярной блокаде. Вы узнаете о причинах развития СА-блокады, степени проявления и их особенностях, симптомах, диагностике, вариантах лечения, прогнозе.
А здесь подробнее о симптомах и лечении предсердной экстрасистолии.
Как проводится электрофизиологическое исследование сердца
Неинвазивное ЭФИ
Алена Жукова
31-03-2008, 17:17
Наличие скрытых аритмий (например, дополнительных проводящих путей и т.д.) – фактор риска внезапной смерти ребенка. Если есть показания к ЭФИ – его делать надо.
Знаете, у меня было и есть наличие этих скрытых аритмий (синдром WPW), но в целом это именно обследование жуткое мне НИЧЕМ не помогло.
И вообще моя мама решила, что оно было проведено не столько с целью мне помочь, а сколько для написания диссертации.
А то что мне помогло – это было хорошее профессиональное обследование ЭХО-графии сердца.
Если на момент установки электродов у пациента нет искомой аритмии, то для успешного определения локализации очага аритмии и ее механизма, необходимо ее спровоцировать. Для индукции используют различные протоколы электрической стимуляции отделов сердца, иногда в сочетании с медикаментозными пробами. После определения свойств аритмии, если после этого не выполняется абляция, ее купируют электрической стимуляцией, кардиоверсией или медикаментозно.
3 этап – удаление катетеров и гемостаз – завершающий этап процедуры, на котором катетеры электроды и интродьюссеры извлекают из организма, а на место пункции накладывают давящую повязку для предотвращения кровотечения.
В послеоперационном периоде необходимо соблюдать постельный режим в течение 4-6 часов.
Показания к проведению
Востребованным показанием к радиочастотной катетерной деструкции является фибрилляция предсердий (синоним — мерцательная аритмия). Данная патология в настоящее время исключительно распространена среди населения. Причина — множество очагов, находящихся в левом предсердии в местах впадения в него крупных сосудов — четырёх лёгочных вен. В результате ритм состоит из беспорядочных сокращений сердца.
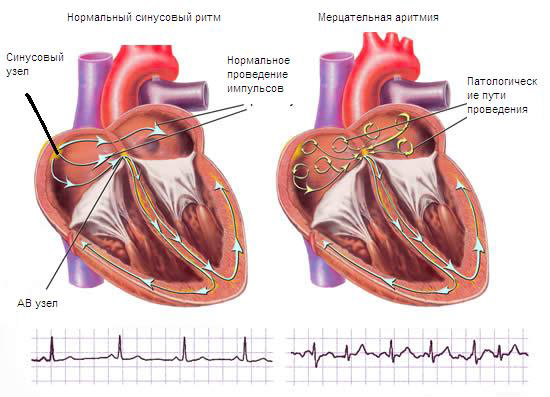
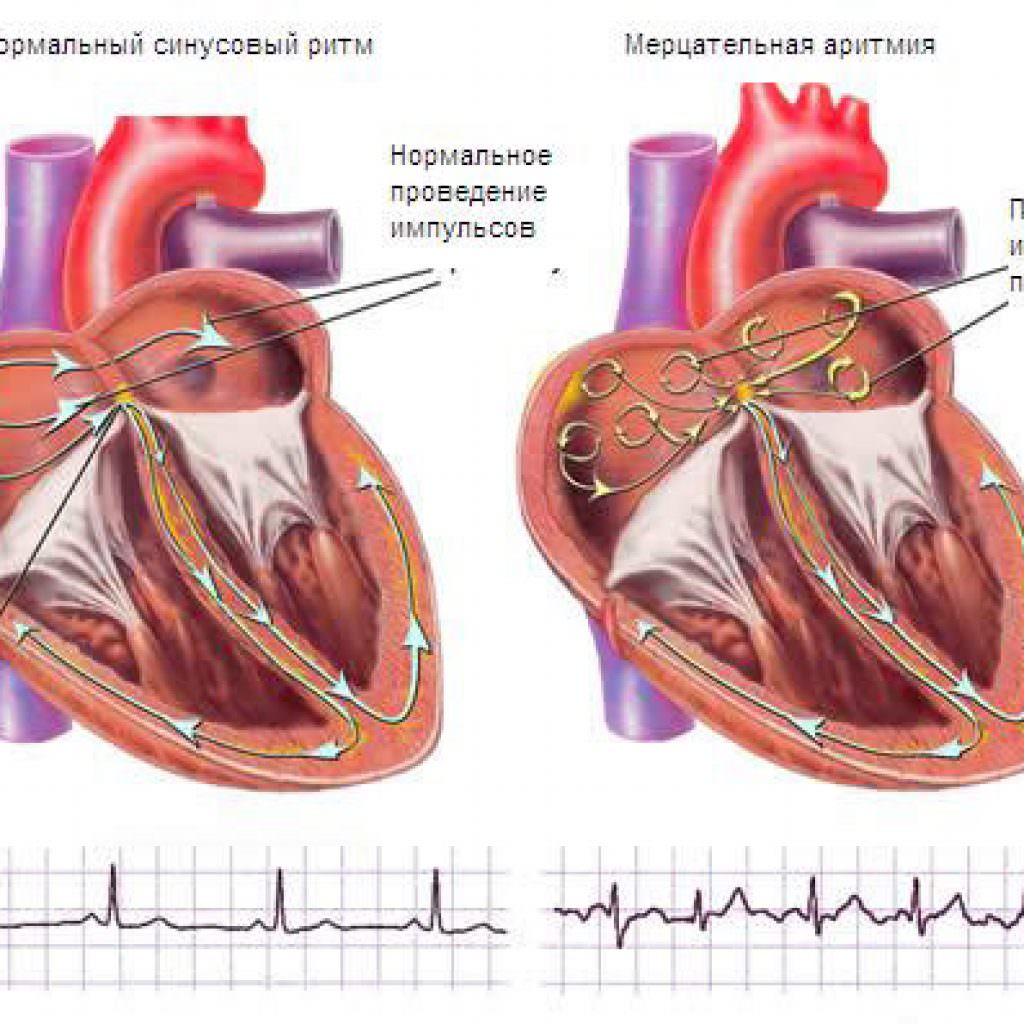
Схема механизма развития мерцательной аритмии
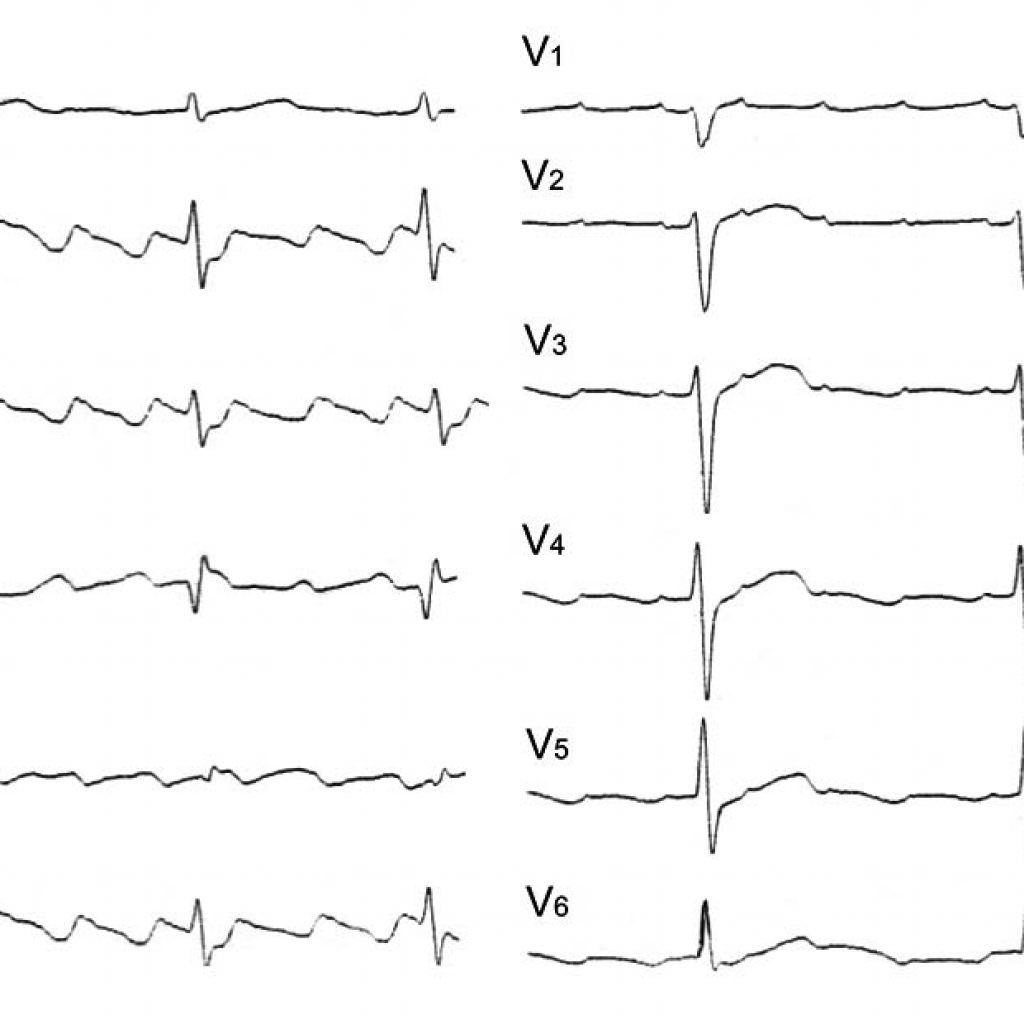
Также показанием к катетерной аблации является врождённая аномалия проводящих путей — синдром Вольфа-Паркинсона-Уайта. В основе лежит активность патологического пути проведения — предсердно-желудочкового пучка. Как следствие появляется изменённая форма ЭКГ. При прохождении электрического сигнала по нормальному и аномальному пути наблюдается аритмия с высокой частотой сокращений сердца, которая может привести к летальному исходу из-за перехода её в более опасные виды нарушений ритма.
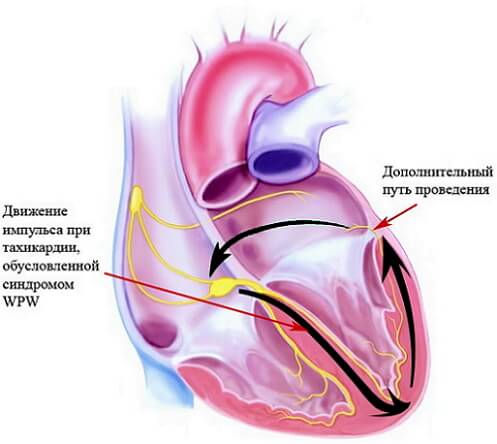
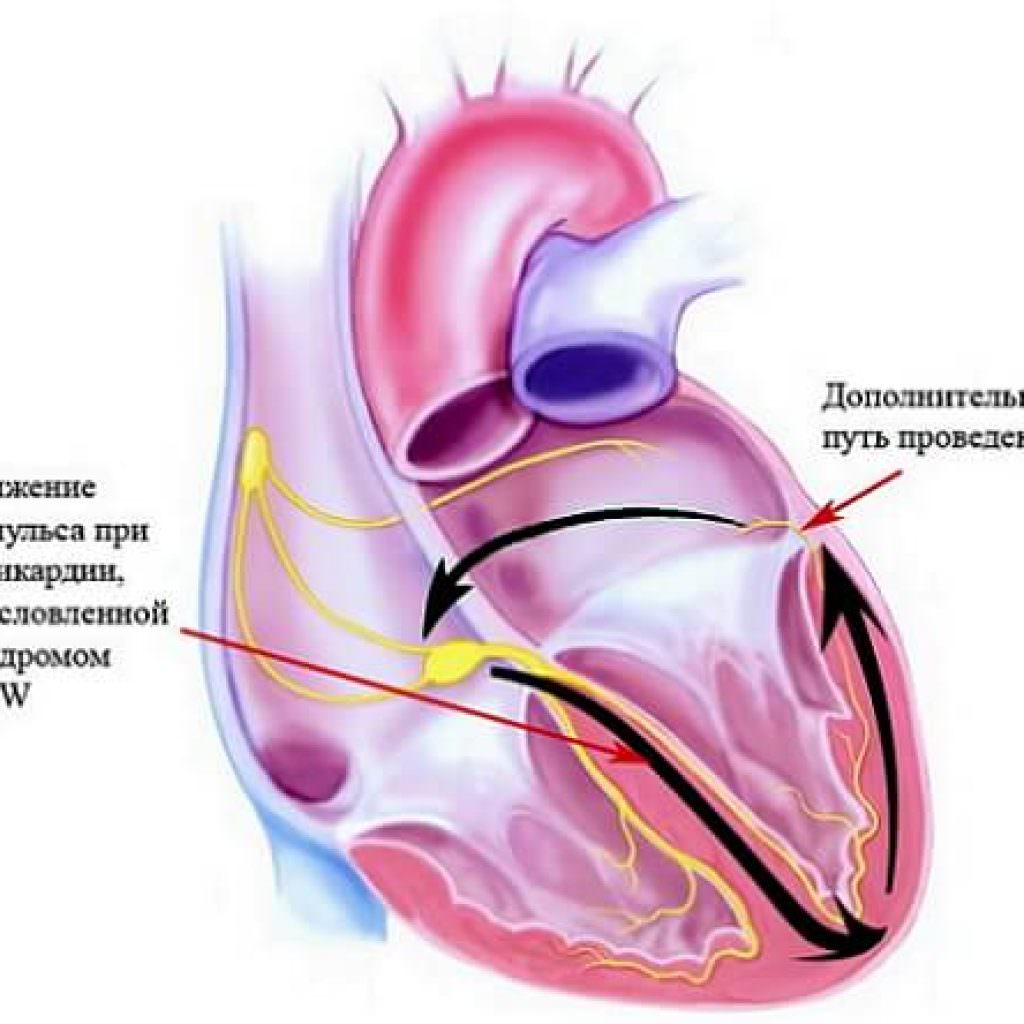
Схема механизма развития тахикардии при синдроме Вольфа-Паркинсона-Уайта
Очень похож на предыдущий другой вид аритмии — атриовентрикулярная узловая тахикардия. Она характеризуется циркуляцией электрического сигнала по двум путям — нормальному и аномальному. Однако оба проходят в составе одного анатомического образования — атриовентрикулярного узла.
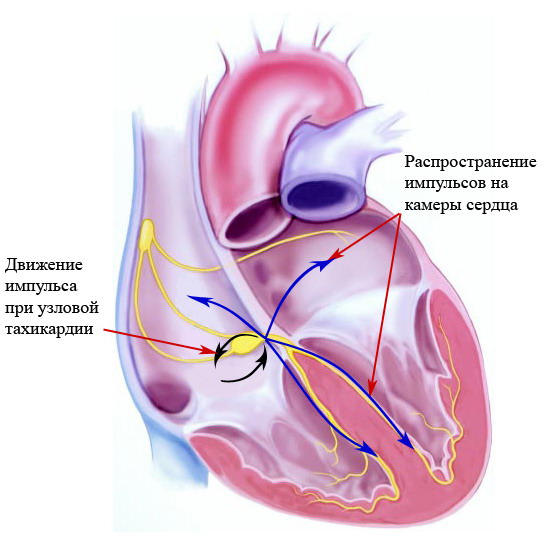
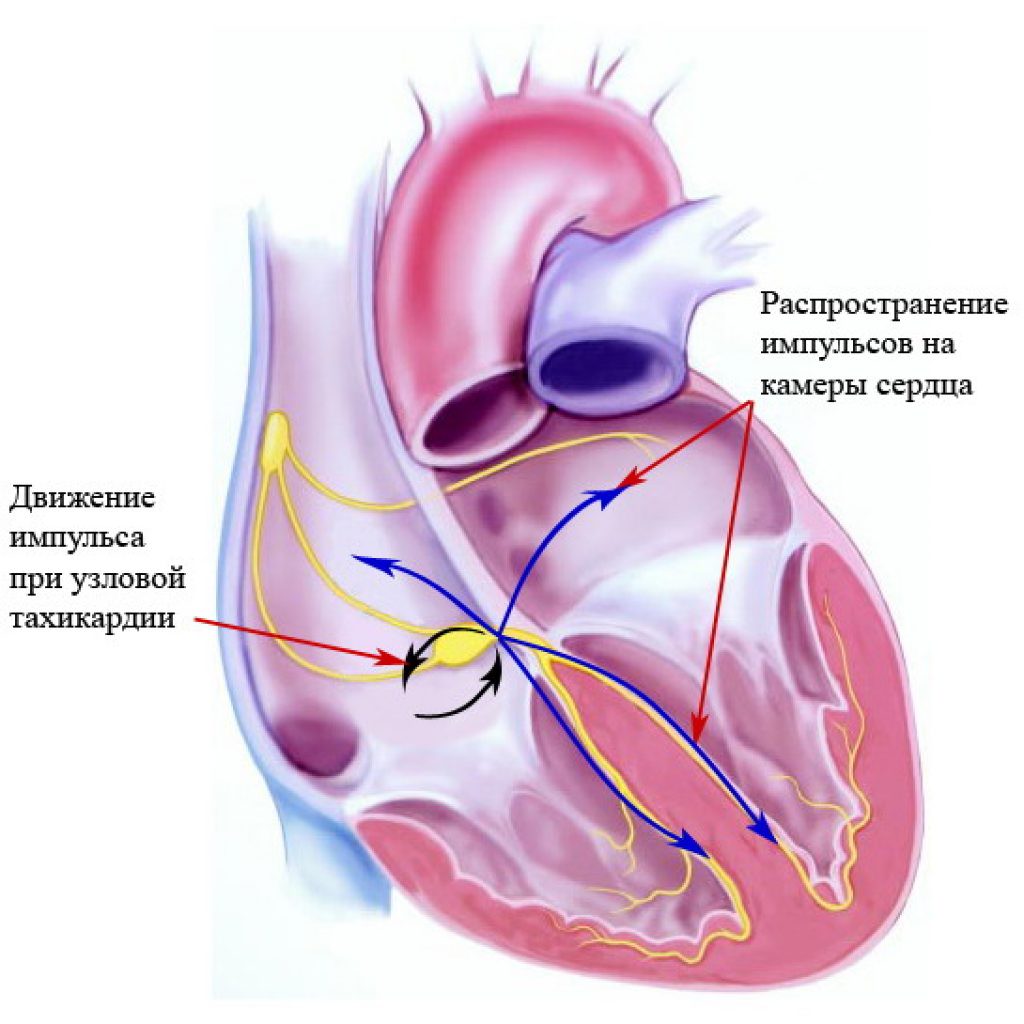
Схема механизма развития атриовентрикулярной узловой тахикардии
Трепетание предсердий — ещё один важный аспект показаний к проведению РЧА. Этот вид аритмии представляет собой замкнутую электрическую цепь. Проходя по ней, электрический сигнал формирует на ЭКГ картину крупных волн (отсюда произошло название аритмии). Цель РЧА — сделать неактивным слабое место этой цепи.
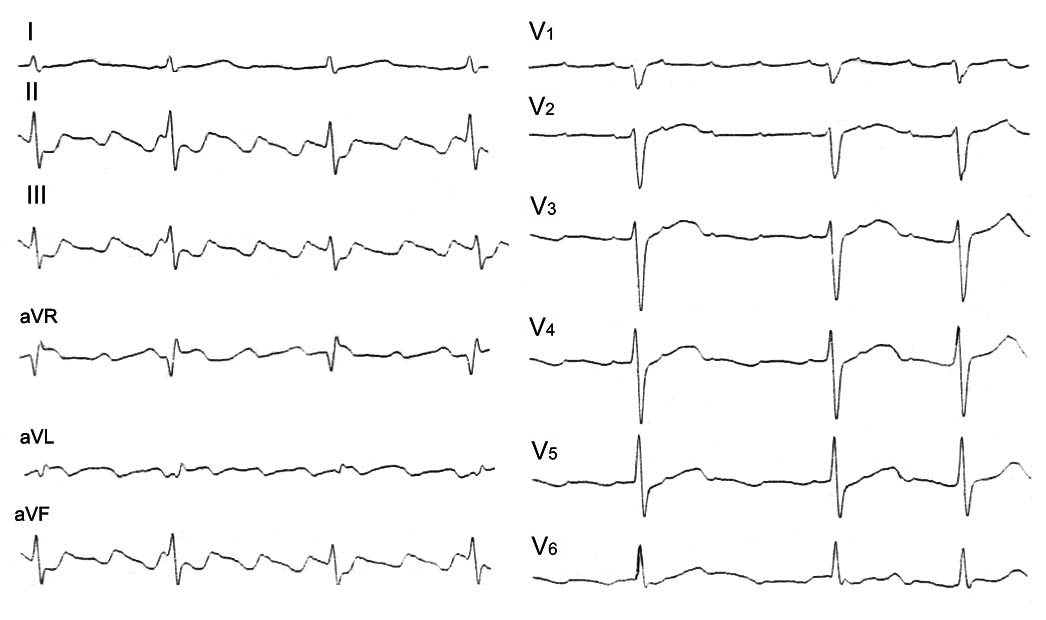
ЭКГ-картина трепетания предсердий
Важным показанием является желудочковая экстрасистолия. Данный термин обозначает электрический сигнал, вызвавший сокращение сердца вне очереди. Причиной является активный электрический участок сердечной ткани, расположенный в желудочках сердца (основных насосных элементах). Для решения о проведении РЧА важным параметром является количество подобных сокращений за сутки. Операция применяется при наличии на фоне нормального ритма более двадцати тысяч экстрасистол.
Противопоказания
К противопоказаниям относятся:
- острые респираторные заболевания;
- острый период инсульта и инфаркта миокарда;
- обострение хронических заболеваний;
- отклонения от нормы в лабораторных показателях;
Установка кардиовертера
Кардиоверсией называется принудительное восстановление естественного (синусового) ритма сердечной деятельности. Устройство для такого лечения называется кардиовертером-дефибриллятором. Его пластины прикладывают к наружной оболочке сердца, а сам прибор вшивают под кожу грудной клетки.

Показания для кардиоверсионного метода симуляции:
- злокачественные аритмии с устойчивостью к медикаментам;
- невозможность проведения радикальной хирургической операции;
- комбинированные нарушения ритма.
Нарушения в работе прибора могут быть при разрядке батареи, образовании соединительной ткани в месте прикрепления электродов. Это затрудняет проведение электроимпульса и вызывает повышенный риск приступов разрозненного сокращения мышечных волокон миокарда (фибрилляции).
EP suite от GE Healthcare
Программно-аппаратный комплекс компании GE Healthcare для электрофизиологических (ЭФ) исследований и процедур позволяет регистрировать электрические сигналы, получать высококачественные изображения анатомических структур при минимальной дозе облучения, осуществлять трехмерную ротационную ангиографию и предусматривает возможность интеграции компонентов. Решение GE стимулирует критическое мышление, обеспечивая электрофизиологов информацией, необходимой для диагностики и лечения сердечно-сосудистых заболеваний, а форма представления информации дает врачу возможность сосредоточиться на пациенте, а не на процессе.
Наши решения в сфере электрофизиологии являются комплексными и обеспечивают бесперебойный поток данных с момента обращения пациента. Они дают возможность объединить ваше оборудование в единую надежную систему, — даже если отдельные предметы оборудования изготовлены не GE Healthcare. Чтобы добиться его сетевой совместимости, мы продумали все до мелочей, а значит, вы можете сосредоточиться на своих пациентах
, — говорит Жан-Мишель Милль, генеральный менеджер по вопросам электрофизиологии отдела интервенционных систем GE Healthcare.
Ядром комплекса EP suite является CardioLab Recording System. Основанная на той же платформе, что и ее предшественница — система электрофизиологического мониторинга Prucka CardioLab, — данная система обеспечивает интеграцию данных, хорошо отлаженный рабочий процесс и высокое качество сигнала — все, что необходимо врачам-электрофизиологам при диагностике и лечении пациента. Главное — это исключительное качество сигнала. Алгоритмы обработки сигнала CardioLab позволяют жестко контролировать форму сигнала, а высокопроизводительный усилитель CLab II Plus обеспечивает его безупречное качество, необходимое при 224 катетерных входах и регистрации по 128 биполярным каналам.
 CardioICE позволяет объединять данные электрофизиологических исследований с внутрисердечной кардиографией в режиме реального времени, что помогает врачу уверенно осуществлять самые современные ЭФ манипуляции. Алгоритмы регистрации и клинические приложения CardioLab совместимы с портативными УЗИ аппаратами для высокопроизводительных кардиоваскулярных исследований Vivid i и Vivid q. CardioICE воспроизводит дисплей Vivid i/q в окне CardioLab XTi, что дает возможность наблюдать за анатомическими структурами и инструментами в режиме реального времени, синхронизируя изображение с ЭКГ. Ряд параметров ультразвукового исследования можно регулировать с помощью пульта дистанционного управления с центрального поста, что позволяет оператору оставаться вне поля облучения и делает его работу более безопасной.
CardioICE позволяет объединять данные электрофизиологических исследований с внутрисердечной кардиографией в режиме реального времени, что помогает врачу уверенно осуществлять самые современные ЭФ манипуляции. Алгоритмы регистрации и клинические приложения CardioLab совместимы с портативными УЗИ аппаратами для высокопроизводительных кардиоваскулярных исследований Vivid i и Vivid q. CardioICE воспроизводит дисплей Vivid i/q в окне CardioLab XTi, что дает возможность наблюдать за анатомическими структурами и инструментами в режиме реального времени, синхронизируя изображение с ЭКГ. Ряд параметров ультразвукового исследования можно регулировать с помощью пульта дистанционного управления с центрального поста, что позволяет оператору оставаться вне поля облучения и делает его работу более безопасной.
 Созданный GE Healthcare ангиограф Innova может быть без труда интегрирована в CardioLab, что дает возможность оптимизировать рабочий процесс и использовать инновационные инструменты анализа, которые повышают достоверность клинических данных. Семейство высокотехнологичных цифровых рентгеновских систем для сердечно-сосудистой диагностики Innova позволяет получать изображения превосходного качества. Технология, обеспечивающая минимальную лучевую нагрузку, и функции регулирования дозы облучения помогают защитить врачей и пациентов от радиационного облучения. Независимые исследования подтверждают, что дозы облучения при проведении рентгеноскопии с помощью системы Innova на 22-75% ниже, чем при использовании других систем с плоскопанельными детекторами.
Созданный GE Healthcare ангиограф Innova может быть без труда интегрирована в CardioLab, что дает возможность оптимизировать рабочий процесс и использовать инновационные инструменты анализа, которые повышают достоверность клинических данных. Семейство высокотехнологичных цифровых рентгеновских систем для сердечно-сосудистой диагностики Innova позволяет получать изображения превосходного качества. Технология, обеспечивающая минимальную лучевую нагрузку, и функции регулирования дозы облучения помогают защитить врачей и пациентов от радиационного облучения. Независимые исследования подтверждают, что дозы облучения при проведении рентгеноскопии с помощью системы Innova на 22-75% ниже, чем при использовании других систем с плоскопанельными детекторами.
Innova EPVision представляет собой приложение, которое обеспечивает динамическое слияние двумерных рентгеновских изображений и 3D моделей, в частности трехмерных моделей сердца, полученных методами ротационной ангиографии, МРТ и КТ, и позволяет отслеживать перемещение инструментов в процессе любой процедуры. Такие функции стабилизации изображения как ЭКГ-синхронизация и детектор движения помогают уменьшить смещение изображений.
С помощью Innova 3D Cardiac врач может быстро построить 3D-изображение левого предсердия для осуществления различных процедур. Теперь полученные трехмерные модели можно экспортировать во все основные системы, работающие с трехмерными изображениями.
Виды стимуляции и их особенности
Стимуляция сокращений сердца с помощью электрических импульсов может быть назначена для временного восстановления ритма, определения резервных возможностей миокарда или для постоянного воздействия.
Рекомендуем прочитать об операции по установке кардиостимулятора. Вы узнаете о типах кардиостимуляторов, показаниях к установке, методике имплантации, осложнениях, замене батареи.
А здесь подробнее о правилах жизни после установки кардиостимулятора.
Чреспищеводная кардиостимуляция
В пищевод пациента вводится зонд с электродом до уровня левого предсердия. Через него подается электрический импульс. Ритм устанавливается в зависимости от цели: диагностика или лечение.
Для выявления ишемической болезни (как альтернатива физической нагрузке) сердце получает более частые импульсы, чем собственные – от 100 до 160 сокращений за 60 секунд. Таким образом создаются условия, при которых миокард испытывает высокую потребность в снабжении кровью. Оценивается наличие ишемии миокарда и ее степень.

Исследование проводится также при подозрении на нарушенную проводимость сердца:
- замедление сердцебиения;
- брадиаритмия;
- приступообразные нарушения ритма;
- наджелудочковые тахикардии.
При этих состояниях стимуляция сердца через пищевод применяется и с лечебной целью для временного восстановления нормального ритма. Несмотря на то, что воздействие на миокард кратковременное, оно может приводить к осложнениям в виде тяжелых приступов аритмии, стенокардии, поэтому показания к такой диагностической процедуре ограничены.
Временная трансвенозная стимуляция
Замедление сердечного ритма может привести к тяжелым нарушениям снабжения органов кровью. Для коррекции этой патологии часто используется эндокардиальная (трансвенозная) стимуляция. В правый отдел сердца (желудочек или предсердие) заводится электрод через крупную вену.
Система трансвенозного электрода для временной стимуляции сердца
Показания к трансвенозному воздействию стимулятора ритма:
- Перед установкой кардиостимулятора (как подготовительный этап).
- Невозможно установить ИВР.
- Приступы потери сознания из-за аритмии.
- При инфаркте миокарда.
- Передозировке антиаритмических препаратов.
- После операций на сердце.
- Блокады проводимости миокарда.
- Приступы тахикардии на фоне редкого сердцебиения.
Осложнениями стимуляции через вены может быть смещение электрода за стенки сосуда, образование тромбов, закупорка сосудов, инфицирование.
О том, как проводят трансвенозную временную кардиостимуляцию, смотрите в этом видео:
Постоянная ЭКС пейсмекером
Пейсмекером называется искусственный водитель ритма, который при нарушении образования собственных сократительных импульсов может образовать электрические. Современные устройства обладают функцией поддержания нормального сердечного ритма не только в покое, но и могут реагировать на изменение физической активности, температуры тела, эмоционального состояния.
Установка кардиостимулятора осуществляется путем подшивания генератора импульсов под кожу грудной клетки, а электрод через вену проводится в один из правых отделов сердца (желудочек или предсердие). Может одновременно производиться подача сигналов на оба отдела при сложных нарушениях ритма. Частота сокращений настраивается индивидуально, под каждого пациента.
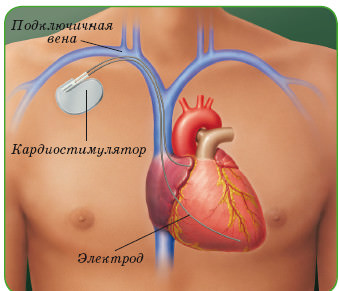
Показания для имплантации пейсмекера:
- постоянная брадикардия;
- повышенный риск остановки сокращений сердца;
- приступообразные тахикардии;
- блокада проводимости между отделами сердца в тяжелой форме.
Осложнением такой операции может быть кровотечение, инфекционное воспаление, тромбирование сосудов. Они встречаются довольно редко. Чаще всего возникает тахикардия, иногда с проявлениями сердечной недостаточности. Для диагностики используется мониторинг деятельности сердца с помощью электрокардиографии.
О том, как устанавливают кардиостимулятор под местной анестезией, смотрите в этом видео:
Можно ли отказаться от кардиостимулятора
Обычно установка кардиостимулятора предполагает извлечение корпуса из-под кожи для замены батареи. Даже если врач на основании данных о соотношении собственных и навязанных импульсов делает вывод о восстановлении синусового ритма у пациента, то полный отказ от прибора не рекомендуется. Таким больным для снижения риска аритмии в дальнейшем ЭКС назначается для подстраховки.
 Усовершенствованная модель кардиостимулятора Micra TPS (22 мм), не требует хирургического вмешательства для установки.
Усовершенствованная модель кардиостимулятора Micra TPS (22 мм), не требует хирургического вмешательства для установки.
Электроды, как правило, остаются в вене, если нет признаков воспалительного процесса, так как для их удаления может потребоваться довольно травматичное вмешательство, они также частично обрастают соединительной тканью, что затрудняет их полное извлечение. Целесообразность такой операции низкая.
Кардиолог.тру
Нарушения ритма сердца
НРС- это изменения частоты, регулярности и источника возбуждения сердца, а также последовательности возбуждения камер сердца.
НРС- чаще всего синдром, осложняющий течение того или иного заболевания, и только в случае врожденной аномалии развитии проводящей системы сердца НРС могут быть основными заболеваниями.
Основные причины возникновения НРС:
I.Функциональные — при относительно здоровом сердце:
- Психогенные
- Рефлекторные
II. Органические — при различных заболеваниях сердца
- ИБС, АГ
- Кардиомиопатии
- Миокардиты
- Пороки сердца
- Токсические аритмии- при интоксикации наперстянкой, анестетиками, адреналином, кофеином и др.
- Электролитный дисбаланс
- Механические повреждения- при интракардиальной катетеризации, при операциях, травмы сердца и легких.
- Наследственные- синдром удлиненного Q-T, синдром Бругада, синдром Вольф- Паркинсон- Уайта, СССУ, наследственные АВ- блокады, наследственные БНПГ, синдром Кернса- Сейра.
Кроме этиологии НРС необходимо учитывать так называемые пусковые факторы аритмий, которые являются обычно непосредственной причиной «срыва» ритма. Для различных нарушений ритма сердца характерны различные пусковые факторы:
- для атриовентрикулярной тахикардии- это прыжок с высоты, внезапный поворот тела;
- для пароксизмальной ФП- это употребление алкоголя, чая, кофе, эмоциональный стресс;
- для желудочковой тахикардии- это физическая нагрузка, эмоциональный стресс, алкоголь.
Методы обследования больных с НРС:
1. Анамнез: Жалобы больных с НРС:
- Кратковременные потери сознания
- Кратковременные эпизоды потемнения перед глазами
- Кратковременныеголовокружения
- Приступы сердцебиения
- Перебои, «замирание» сердца.
При сборе анамнеза необходимо выяснить, чем провоцируются эти состояния; четко определить продолжительность этих состояний и частоту их возникновения; выяснить характер начала и конца приступов (внезапный, постепенный); попытаться выяснить, чем купируется это состояние; необходимо оценить состояние больного во время приступа сердцебиения.
2. Осмотр больного — аритмичность пульса, дефицит пульса, редкий пульс с паузами, дополнительные преждевременные сокращения сердца и паузы после них, если они имеют место в данное время. Кроме того, при осмотре больного возможно выявление признаков различных заболеваний, которые могут причиной возникновения аритмий.
3. Инструментальное обследование :
- ЭКГ
- ХМ-ЭКГ
- ЭХО-КГ
- ВЭМ, тредмил
- Оценка ЩЖ ( уровень гормонов, УЗИ)
- ЭФИ, чреспищеводное и эндокардиальное во время котрого оценивают состояние проводящей системы сердца, наличие аномалий ее развития.

Comments
(0 Comments)