Блокаторы ангиотензиновых рецепторов
Эффекты
Ингибиторы АПФ предотвращают превращение ангиотензина I в ангиотензин II; блокаторы АТ блокируют действие ангиотензина II на стенку
сосудов и не влияют на уровень брадикинина. Этот эффект ингибиторов АПФ и блокаторов АТ приводит к следующим событиям:
- Расширению артериол, вызывающему снижение общего периферического сопротивления.
- Уменьшению воздействия ангиотензина на симпатическую активность и высвобождению норадреналина. Снижение симпатической активности ведет к вазодилатации, уменьшению постнагрузки и некоторому снижению преднагрузки. Также эти препараты не увеличивают ЧСС в отличие от других вазодилататоров.
- Снижению секреции альдостерона, что стимулирует экскрецию натрия и задержку калия.
- Блокаде ангиотензинопосредованного выброса вазопрессина — важного механизма при СН.
- Активации фермента (идентичен киназе II), вызывающего расщепление брадикинина. Накопление брадикинина стимулирует выброс вазодилатирующих простагландинов, которые тоже вносят свой вклад в снижение общего периферического сопротивления. Поэтому индометацин и другие ингибиторы простагландинов снижают эффективность ингибиторов АПФ.
Советы по применению, побочные эффекты и лекарственные взаимодействия Ингибиторы АПФ задерживают калий, поэтому их не следует назначать в сочетании с препаратами калия и калийсберегающими диуретиками, а также препаратами Aldactazide (спиронолактон + гидрохлортиазид), Dyazide (триамтерен + гидрохлортиазид), Maxzide (триамтерен + гидрохлортиазид) и Moduretic (Moduret) (амилорид + гидрохлортиазид). При почечной недостаточности тоже может возникать гиперкалиемия. Почти у 20% наблюдается появление кашля; отек Квинке обсуждается в главе 3. Примерно у 1% больных каптоприл вызывает протеинурию, чаще у больных с предшествующей патологией почек, принимающих более 150 мг препарата в день. Протеинурия при сахарном диабете не является противопоказанием, поскольку было показано, что препарат снижает у некоторых таких больных протеинурию /36, 37/. Среди побочных эффектов были зарегистрированы случаи появления кожного зуда и сыпи у 10% больных, потери вкусовых ощущений — у 7% /38/, а также язвенного стоматита, неврологических и желудочно-кишечных расстройств.
|
Название препарата: Эналаприл
|
В отдельных случаях суточная доза должна быть разделена на два приема для 24-часового контроля АД. Обычная рекомендуемая начальная доза для больных, не принимающих диуретики, составляет 5 мг один раз в день, за исключением пожилых и пациентов с почечной патологией, а также при подозрении на высокий уровень ренина, как при стенозе почечной артерии, предшествующем приеме диуретиков и бессолевой диете. В таких ситуациях рекомендуется доза 2,5 мг
Отметим, что уровень креатинина крови может быть в норме у больных старше 70 лет с патологией почек, поэтому необходима осторожность
Дозы ингибиторов АПФ и блокаторов АТ приведены в табл. 8.8 и 8.9 соответственно. Максимальные дозы, приведенные в этих таблицах, приблизительно на 20% ниже, чем указывает производитель. Автор не рекомендует для контроля АД назначения максимальных доз, указанных производителем. Целевой уровень АД должен достигаться с помощью примерно 75% максимальной дозы. Если он не достигается, то необходима комбинация с небольшой дозой другого препарата.
Эффекты, фармакокинетику и побочные эффекты других ингибиторов АПФ и блокаторов АТ см. в главе 2.
Комбинации ингибиторов АПФ с диуретиками Capozide: 15-30 мг содержат 15 мг каптоприла и 30 мг гидрохлортиазида для двукратного приема. Препарат обладает недостатками, типичными для фиксированных комбинаций лекарственных средств.
Vaseretic: 10-25 мг содержат 10 мг эналаприла и 25 мг гидрохлортиазида. Эффективен при приеме один раз в день. Не рекомендуется при патологии почек с уровнем креатинина > 2,3 мг/дл (203 мкмоль/л).
Hyzaar: Комбинация 50 мг лозаротана и 12,5 мг гидрохлортиазида. Препарат не должен применяться в качестве начальной терапии
Рецепторы ангиотензина II
Основные эффекты ангиотензина II осуществляются через его взаимодействие со специфическими клеточными рецепторами. В настоящее время выделено несколько типов и подтипов ангиотензиновых рецепторов: АТ1, АТ2, АТ3 и АТ4. У человека обнаружены только АТ1, — и АТ2-рецепторы. Первый тип рецепторов подразделяется на два подтипа — АТ1А и АТ1В. Ранее считали, что АТ1А- и АТ2В-подтипы имеются только у животных, но в настоящее время они идентифицированы и у человека. Функции этих изоформ окончательно не ясны. АТ1А-рецепторы превалируют в гладкомышечных клетках сосудов, сердце, легких, яичниках и в гипоталамусе. Преобладание АТ1А-рецепторов в гладких мышцах сосудов свидетельствует об их роли в процессах вазоконстрикции. В связи с тем что АТ1В-рецепторы превалируют в надпочечниках, матке, передней доле гипофиза, можно полагать, что они вовлечены в процессы гормональной регуляции. Предполагается наличие АТ1С — подтипа рецепторов у грызунов, однако точная их локализация не установлена.
Известно, что все сердечно-сосудистые, а также экстракардиальные эффекты ангиотензина II опосредуются преимущественно через АТ1 -рецепторы.
Они обнаружены в тканях сердца, печени, мозга, почек, надпочечников, матки, эндотелиальных и гладкомышечных клетках, фибробластах, макрофагах, периферических симпатических нервах, в проводящей системе сердца.
 Эффекты ангиотензина II, опосредуемые через АТ1- и АТ2-рецепторы
Эффекты ангиотензина II, опосредуемые через АТ1- и АТ2-рецепторы
Об АТ2 -рецепторах известно значительно меньше, чем о рецепторах АТ1-типа. АТ2 -рецептор впервые был клонирован в 1993 г., установлена его локализация на Х-хромосоме. Во взрослом организме АТ2-рецепторы представлены в высоких концентрациях в мозговом слое надпочечников, в матке и яичниках, обнаружены они также в сосудистом эндотелии, сердце и различных областях мозга. В эмбриональных тканях АТ2-рецепторы представлены значительно шире, чем во взрослых и являются в них преобладающими. Вскоре после рождения АТ2-рецептор «выключается» и активируется при определенных патологических состояниях, таких, как ишемия миокарда, сердечная недостаточность, повреждение сосудов. То, что АТ2-рецепторы наиболее широко представлены в тканях плода и их концентрация резко снижается в первые недели после рождения, свидетельствует об их роли в процессах, связанных с клеточным ростом, дифференциацией и развитием.
Считают, что АТ2-рецепторы опосредуют апоптоз — запрограммированную гибель клетки, являющуюся закономерным следствием процессов ее дифференциации и развития. Благодаря этому стимуляция АТ2-рецепторов оказывает антипролиферативное действие.
АТ2-рецепторы считают физиологическим противовесом АТ1-рецепторов. Очевидно, они контролируют избыточный рост, опосредованный через АТ1-рецепторы или другие факторы роста, а также уравновешивают вазоконстрикторный эффект стимуляции АТ1-рецепторов.
Полагают, что основным механизмом вазодилатации при стимуляции АТ2-рецепторов является образование оксида азота (NО) эндотелием сосудов.
Пути образования ангиотензина II
В соответствии с классическими представлениями основной эффекторный гормон ренин-ангиотензиновой системы ангиотензин II образуется в системном кровотоке в результате каскада биохимических реакций. В 1954 г. L. Skeggs и группа специалистов из Кливленда установили, что ангиотензин представлен в циркулирующей крови двумя формами: в виде декапептида и октапептида, впоследствии получивших название ангиотензин I и ангиотензин II.
Ангиотензин I образуется в результате его отщепления от ангиотензиногена, вырабатываемого клетками печени. Реакция осуществляется под действием ренина. В дальнейшем этот неактивный декаптид подвергается воздействию АПФ и в процессе химической трансформации превращается в активный октапептид ангиотензин II, являющийся мощным вазоконстрикоторным фактором.
Помимо ангиотензина II физиологические эффекты ренин-ангиотензиновой системы осуществляются еще несколькими биологически активными веществами. Наиболее важным из них является ангиотензин(1-7), образующийся преимущественно из ангиотензина I, а также (в меньшей степени) — из ангиотензина II. Гептапептид(1-7) оказывает вазодилатирующее и антипролиферативное действие. На секрецию альдостерона он, в отличие от ангиотензина II, не оказывает влияния.
Под воздействием протеиназ из ангиотензина II образуется еще несколько активных метаболитов — ангиотензин III, или ангиотензин(2-8) и ангиотензин IV, или ангиотензин(3-8). С ангиотензином III связаны процессы, способствующие повышению АД, — стимуляция рецепторов ангиотензина и образование альдостерона.
Исследования последних двух десятилетий показали, что ангиотензин II образуется не только в системном кровотоке, но и в различных тканях, где обнаружены все компоненты системы ренин—ангиотензин (ангиотензиноген, ренин, АПФ, рецепторы ангиотензина), а также выявлена экспрессия генов ренина и ангиотензина II. Значение тканевой системы обусловлено ее ведущей ролью в патогенетических механизмах формирования заболеваний сердечно-сосудистой системы на органном уровне.
В соответствии с концепцией о двухкомпонентности ренин-ангиотензиновой системы системному звену отводят ведущую роль в ее кратковременных физиологических эффектах. Тканевое звено ренин-ангиотензиновой системы обеспечивает долговременное действие на функцию и структуру органов. Вазоконстрикция и освобождение альдостерона в ответ на стимуляцию ангиотензином являются немедленными реакциями, возникающими в течение секунд, в соответствии с их физиологической ролью, которая заключается в поддержке кровообращения после кровопотери, дегидратации или при ортостатических изменениях. Другие эффекты — гипертрофия миокарда, сердечная недостаточность — развиваются в течение длительного периода. Для патогенеза хронических заболеваний сердечно-сосудистой системы медленные ответы, осуществляемые на тканевом уровне, более важны, чем быстрые, реализуемые системным звеном ренин-ангиотензиновой системы.
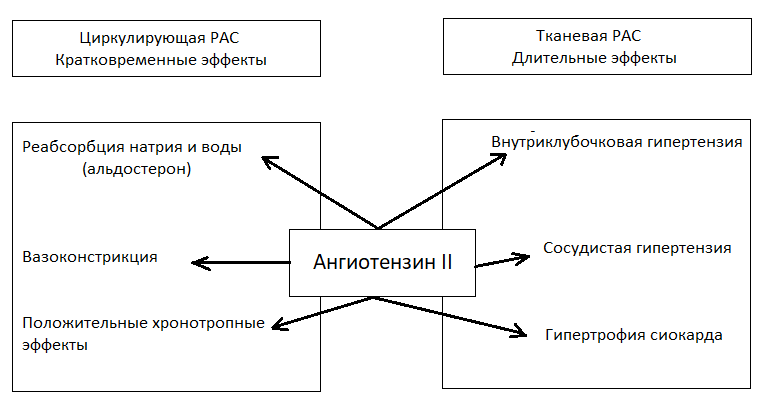 Физиологические эффекты циркулирующей и тканевой ренин-ангиотензиновой системы (РАС)
Физиологические эффекты циркулирующей и тканевой ренин-ангиотензиновой системы (РАС)
Помимо АПФ-зависимого превращения ангиотензина I в ангиотензин II установлены альтернативные пути его образования. Было выявлено, что накопление ангиотензина II продолжается, несмотря на почти полную блокаду АПФ с помощью его ингибитора эналаприла. В последующем было установлено, что на уровне тканевого звена ренин-ангиотензиновой системы образование ангиотензина II происходит без участия АПФ. Превращение ангиотензина I в ангиотензин II осуществляется с участием других ферментов — тонина, химаз и катепсина. Эти специфические протеиназы способны не только конвертировать ангиотензин I в ангиотензин II, но и отщеплять ангиотензин II непосредственно от ангиотензиногена без участия ренина. В органах и тканях ведущее место занимают независимые от АПФ пути образования ангиотензина II. Так, в миокарде человека около 80% его образуется без участия АПФ.
В почках содержание ангиотензина II в два раза превосходит содержание его субстрата ангиотензина I, что свидетельствует о превалировании альтернативного образования ангиотензина II непосредственно в тканях органа.

Comments
(0 Comments)